
【题目】下列说法正确的是( )
A.实验室制备乙烯时,温度计水银球应该插入浓硫酸和无水乙醇的混合液液面以下
B.人体摄入的纤维素可以加快胃肠蠕动,并最终水解为葡萄糖而被吸收
C.![]() 分子中的所有原子有可能共平面
分子中的所有原子有可能共平面
D.溴水中加入苯,充分振荡、静置后,由于发生取代反应而水层几乎呈无色
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】小明同学想测量某赤铁矿样品中氧化铁的纯度(假设其他成分不与酸反应,也不溶于水),进行了如下实验:称取10.00 g赤铁矿样品,加入到烧杯中,再加入92.50 g 的稀硫酸,恰好完全反应,过滤得滤渣2.50 g。试计算:
(1)赤铁矿样品中氧化铁的质量分数?___________
(2)上述反应后所得滤液中溶质的质量分数?___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 碳酸钠溶液可用于治疗胃病 |
| Ⅰ对,Ⅱ对,有 |
B | 向滴有酚酞的水溶液中加入 |
| Ⅰ对,Ⅱ错,无 |
C | 分别加热 | 两种物质均受热分解 | Ⅰ对,Ⅱ对,有 |
D | 过氧化钠可为航天员供氧 |
| Ⅰ对,Ⅱ对,有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]易溶于水,在定量分析中常用来配制亚铁离子的标准溶液。某化学课外小组同学设计并完成下列实验。
I.(NH4)2Fe(SO4)2·6H2O的制取
实验步骤:
①称取4.2g碎铁屑于锥形瓶中,加入10mL30%的NaOH溶液,加热煮沸-段时间。倾去碱液,水洗至中性。
②向处理过的铁屑中加入25mL3mol/LH2SO4,水浴加热至反应完全,趁热过滤。
③向滤液中加入-定体积的饱和(NH4)2SO4溶液,加热浓缩,冷却,抽滤,洗涤,干燥得产品。
(1)步骤①中加入NaOH溶液的目的是___。
(2)步骤②趁热过滤的目的是___。
(3)步骤③加热浓缩溶液时,需要的仪器有酒精灯、___、___(固定、夹持仪器除外)。
Ⅱ.(NH4)2Fe(SO4)2·6H2O和FeSO4·7H2O稳定性的对比研究
如图,在2支相同的注射器中分别装入等物质的量的两种晶体,调整2支注射器活塞使空气体积相等,用针头及胶塞封好注射器(气密性良好)。较长时间后,取出两种晶体,分别滴加2滴0.01mol/LKSCN溶液。整个过程中实验现象记录如下:
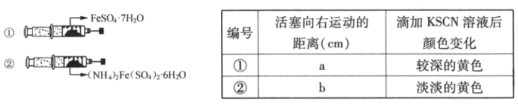
(4)判断a___b(填“>”、“<”或“=”),出现此结果的原因可能是___。
(5)判断此条件下(NH4)2Fe(SO4)2·6H2O的稳定性___(填“大于”或“小于”)FeSO4·7H2O。
Ⅲ.配制(NH4)2Fe(SO4)2溶液并标定浓度
配制(NH4)2Fe(SO4)2溶液100mL,准确量取20.00mL,置于锥形瓶中,加10mLH2SO4和邻二氮菲指示剂3~4滴,用cmol/LK2Cr2O7标准液滴定至溶液变成棕红色。消耗K2Cr2O7溶液的体积为VmL。
(6)计算(NH4)2Fe(SO4)2溶液的浓度为___ mol/L。
(7)下列操作会使所测溶液浓度偏大的是___(填标号)。
A.锥形瓶用待测溶液润洗
B.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
C.滴定过程中剧烈摇晃锥形瓶,溶液溅出
D.滴定前平视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g·cm-3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
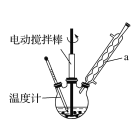
(1)装置a的名称是______________,为使反应体系受热比较均匀,可________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________________________。
(3)写出苯甲醛与银氨溶液在一定的条件下发生反应的化学方程式:________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过____________、__________(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是______________(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定乙醇的结构式,利用乙醇和钠的反应,设计如图1装置进行实验,在烧瓶中放入足量的钠,从分液漏斗中缓缓滴入一定量的乙醇,通过测量量筒中水的体积,就可知反应生成的氢气的体积。
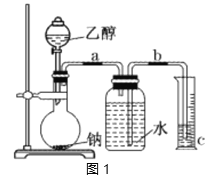
(1)实验前检验该装置的气密性的实验操作是__。
(2)有人认为装置中有空气,所测的气体体积应扣除装置中空气的体积,才是氢气的体积,你认为__(填“正确”或“不正确”)。
(3)若实验中所用乙醇含有少量水则实验结果将_(填“偏大”或“偏小”),若实验开始前b导管内未充满水则实验结果将__(填“偏大”或“偏小”)。
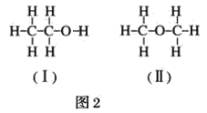
(4)若测得有1.15gC2H6O参加反应,把量筒c中的水的体积换算成标准状况下H2的体积为280mL,试结合计算和讨论,判断图2中(Ⅰ)和(Ⅱ)两式中,哪个正确__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )

A. H2O分解为H2与O2时放出热量
B. 生成1mol H2O时吸收热量245 kJ
C. 甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D. 氢气和氧气的总能量小于水的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时CH3COOH的电离平衡常数为K。该温度下向20mL0.1mol·L-1CH3COOH溶液中逐滴加入0.1mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
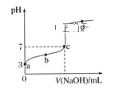
A.a点表示的溶液中c(CH3COO-)略小于10-3mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、c点表示的溶液中![]() 均等于K
均等于K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com