
【题目】如表所示,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 碳酸钠溶液可用于治疗胃病 |
| Ⅰ对,Ⅱ对,有 |
B | 向滴有酚酞的水溶液中加入 |
| Ⅰ对,Ⅱ错,无 |
C | 分别加热 | 两种物质均受热分解 | Ⅰ对,Ⅱ对,有 |
D | 过氧化钠可为航天员供氧 |
| Ⅰ对,Ⅱ对,有 |
A.AB.BC.CD.D
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g)![]() N2O2(g)(快) △H1<0 平衡常数 K1
N2O2(g)(快) △H1<0 平衡常数 K1
②N2O2(g)+O2(g) ![]() 2NO2化) (慢) △H2<0 平衡常数K2
2NO2化) (慢) △H2<0 平衡常数K2
下列说法正确的是
A. 2NO(g) +O2(g)![]() 2NO2(g)的△H= -(△H1+△H2)
2NO2(g)的△H= -(△H1+△H2)
B. 2NO(g) +O2(g)![]() 2NO2 (g)的平衡常数 K =
2NO2 (g)的平衡常数 K =![]()
C. 反应②的速率大小决定2NO(g)+O2(g) ![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
D. 反应过程中的能量变化可用下图表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。M、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1 r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
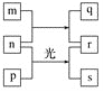
A.W、X组成的化合物只含有极性共价键
B.Y的氢化物常温常压下为液态
C.元素的非金属性Z>X>Y
D.X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OCH3(二甲醚)常用作有机合成的原料,也用作溶剂和麻醉剂。CO2与H2合成CH3OCH3涉及的相关热化学方程式如下:
Ⅰ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
Ⅱ.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
Ⅲ.CO2(g)+H2(g)![]() CO(g)+H2(g) ΔH3
CO(g)+H2(g) ΔH3
Ⅳ.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH4
CH3OCH3(g)+3H2O(g) ΔH4
回答下列问题:
⑴ΔH4=__kJ·mol-1。
⑵体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应能自发进行。反应Ⅰ、Ⅱ、Ⅲ的自由能变与温度的关系如图a所示,在298~998K下均能自发进行的反应为__(填“Ⅰ”“Ⅱ”或“Ⅲ”)。

⑶在三个完全相同的恒容密闭容器中,起始时均通入3molH2和1molCO2,分别只发生反应Ⅰ、Ⅲ、Ⅳ时,CO2的平衡转化率与温度的关系如图b所示。
①ΔH3__0(填“>”或“<”)。
②反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为p(CO2)__pMPa(精确到0.01)。
③在B点对应温度下, K(Ⅰ)__(填“大于”“小于”或“等于”)K(Ⅲ)。
⑷向一体积为1L的密闭容器中通入H2和CO2,只发生反应Ⅳ。CO2的平衡转化率与压强、温度及氢碳比m[m=![]() ]的关系分别如图c和图d所示。
]的关系分别如图c和图d所示。

①图c中压强从大到小的顺序为__,图d中氢碳比m从大到小的顺序为__。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率为50%,则在此温度下该反应的平衡常数K=__(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2NCOONH4(59℃时升华并分解)可用作磷化铝中间体及医药等。可由干燥的NH3与CO2在低温下(或冰水浴)制取,装置如图所示:
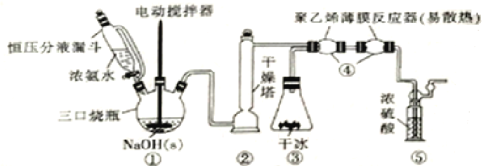
回答下列问题:
(1)装置①中用“恒压分液漏斗”代替普通的分液漏斗,其优点是_____________,滴入浓氨水并搅拌能产生大量NH3的原因是____________________,装置②干燥塔中盛放的合适干燥剂是_____________(填名称)。
(2)装置③用盛干冰装置代替实验室制备CO2的常见制备及纯化转置,其优点除装置简洁且可产生纯净干燥的CO2外,还具有的优点是____________________________________。
(3)装置④用“聚乙烯薄膜反应器”代替反应管的优点是____________,“聚乙烯薄膜反应器”中发生反应的化学方程式为_____________________________________________。
(4)从环境保护角度分析,装置⑤的作用是_____________,还可以通过观察气泡确定NH3和CO2的比例是否合适,判断的依据及不合适时的调节方案为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程:

①从悬浊液中将Mg(OH)2分离出来的操作名称为_____________。
②Mg(OH)2转化为MgCl2的离子方程式是_____________。
③由无水MgCl2制取Mg的化学方程式是_____________。
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧所用仪器是下列中的哪一种_____________(填字母序号)。
a. 蒸发皿 b. 坩埚 c. 烧杯
②向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2,请写出该反应的离子方程式:__________________________。
③上述反应结束后,可加入萃取剂,采用萃取一分液的方法从碘水中提取碘。下列试剂中可以用于萃取碘单质的是_____________(填字母序号)。
a. 乙酸 b. 四氯化碳 c. 硝酸 d. 苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.实验室制备乙烯时,温度计水银球应该插入浓硫酸和无水乙醇的混合液液面以下
B.人体摄入的纤维素可以加快胃肠蠕动,并最终水解为葡萄糖而被吸收
C.![]() 分子中的所有原子有可能共平面
分子中的所有原子有可能共平面
D.溴水中加入苯,充分振荡、静置后,由于发生取代反应而水层几乎呈无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com