
【题目】CH3OCH3(二甲醚)常用作有机合成的原料,也用作溶剂和麻醉剂。CO2与H2合成CH3OCH3涉及的相关热化学方程式如下:
Ⅰ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
Ⅱ.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
Ⅲ.CO2(g)+H2(g)![]() CO(g)+H2(g) ΔH3
CO(g)+H2(g) ΔH3
Ⅳ.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH4
CH3OCH3(g)+3H2O(g) ΔH4
回答下列问题:
⑴ΔH4=__kJ·mol-1。
⑵体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应能自发进行。反应Ⅰ、Ⅱ、Ⅲ的自由能变与温度的关系如图a所示,在298~998K下均能自发进行的反应为__(填“Ⅰ”“Ⅱ”或“Ⅲ”)。

⑶在三个完全相同的恒容密闭容器中,起始时均通入3molH2和1molCO2,分别只发生反应Ⅰ、Ⅲ、Ⅳ时,CO2的平衡转化率与温度的关系如图b所示。
①ΔH3__0(填“>”或“<”)。
②反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为p(CO2)__pMPa(精确到0.01)。
③在B点对应温度下, K(Ⅰ)__(填“大于”“小于”或“等于”)K(Ⅲ)。
⑷向一体积为1L的密闭容器中通入H2和CO2,只发生反应Ⅳ。CO2的平衡转化率与压强、温度及氢碳比m[m=![]() ]的关系分别如图c和图d所示。
]的关系分别如图c和图d所示。

①图c中压强从大到小的顺序为__,图d中氢碳比m从大到小的顺序为__。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率为50%,则在此温度下该反应的平衡常数K=__(保留整数)。
【答案】-122.54 Ⅱ > 0.21 小于 p1>p2>p3 m1>m2>m3 23
【解析】
⑴第Ⅰ个方程式的2倍加上第Ⅱ个方程式。
⑵根据图中信息得到298~998K下只有Ⅱ的ΔG<0。
⑶①升高温度,CO2的平衡转化率增大,说明平衡正向移动,正向是吸热反应;②三段式式建立关系,根据公式求出压强;③根据平衡常数分析产物与反应物的关系。
⑷①利用转化率分析压强,利用一个量不变,另一个量变化来分析。
②建立三段式建立再求平衡常数。
⑴将第Ⅰ个方程式的2倍加上第Ⅱ个方程式得到ΔH4=-122.54 kJ·mol1;故答案为:-122.54。
⑵体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应能自发进行,在298~998K下只有Ⅱ的ΔG<0,因此均能自发进行的反应为Ⅱ;故答案为:Ⅱ。
⑶①升高温度,CO2的平衡转化率增大,说明平衡正向移动,正向是吸热反应,即ΔH3>0;故答案为:>。
②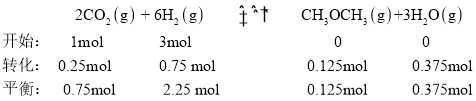 ,反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为
,反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为![]() ;故答案为:0.21。
;故答案为:0.21。
③在B点对应温度下,根据Ⅰ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)和Ⅲ.CO2(g)+H2(g)
CH3OH(g)+H2O(g)和Ⅲ.CO2(g)+H2(g)![]() CO(g)+H2(g)的反应,CO2转化率相等,产物的量相等,但Ⅰ中氢气平衡时量较少,但是大于1的值,由于是浓度三次方,因此平衡常数小,平衡常数K(Ⅰ)小于K(Ⅲ);故答案为:小于。
CO(g)+H2(g)的反应,CO2转化率相等,产物的量相等,但Ⅰ中氢气平衡时量较少,但是大于1的值,由于是浓度三次方,因此平衡常数小,平衡常数K(Ⅰ)小于K(Ⅲ);故答案为:小于。
⑷①该反应是体积减小的反应,图c中定温度,从下到上看,转化率增大,说明平衡正向移动,向体积减小方向移动即加压,压强从大到小的顺序为p1>p2>p3,图d中可以理解为二氧化碳物质的量不变,氢气量不断增加,平衡正向移动,二氧化碳转化率不断增大,因此氢碳比m从大到小的顺序为m1>m2>m3;故答案为:m1>m2>m3。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率为50%, ,则在此温度下该反应的平衡常数
,则在此温度下该反应的平衡常数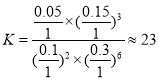 ;故答案为:23。
;故答案为:23。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学想测量某赤铁矿样品中氧化铁的纯度(假设其他成分不与酸反应,也不溶于水),进行了如下实验:称取10.00 g赤铁矿样品,加入到烧杯中,再加入92.50 g 的稀硫酸,恰好完全反应,过滤得滤渣2.50 g。试计算:
(1)赤铁矿样品中氧化铁的质量分数?___________
(2)上述反应后所得滤液中溶质的质量分数?___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把空气中的CO2进行转化,并使之与H2反应生成可再生能源甲醇。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①下列关于氢能的说法正确的是____。
A.氢能是清洁能源 B.氢能是二次能源
C.氢能是不可再生能源 D.气态氢能源更容易保存和运输
②已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJmol-1、-285.8kJmol-1。CO与H2合成甲醇的能量变化如图甲所示:
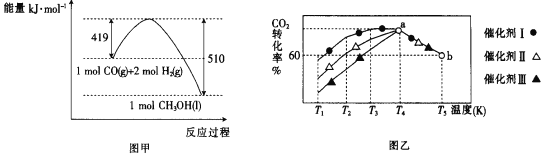
则用CO2(g)和H2(g)制备液态甲醇的热化学方程式为____。
③将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:催化效果最好的是催化剂____(选填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应,得到三组数据如表所示:
温度/℃ | 起始量 | 达到平衡 | |||
CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
650 | 4 | 2 | 1.6 | 10 | |
900 | 3 | 2 |
| 5 | |
900℃时,达到平衡时的反应速率v(H2O)=____。(保留2位小数)。
(3)科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为____。
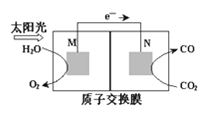
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W的一种核素可在考古时用来推算一些文物的年代;Y原子的最外层电子数为内层电子数的三倍;Z是同周期主族元素中原子半径最大的元素。下列说法中正确的是
A.仅由W、X、Y三种元素组成的化合物可能是离子化合物
B.与Z同主族且处于第六周期的元素的原子序数为55
C.最简单氢化物的稳定性:![]()
D.W与氢元素组成的化合物的沸点一定低于水的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 电解法制取铝单质时也可以采用电解氯化铝以降低成本
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 碳酸钠溶液可用于治疗胃病 |
| Ⅰ对,Ⅱ对,有 |
B | 向滴有酚酞的水溶液中加入 |
| Ⅰ对,Ⅱ错,无 |
C | 分别加热 | 两种物质均受热分解 | Ⅰ对,Ⅱ对,有 |
D | 过氧化钠可为航天员供氧 |
| Ⅰ对,Ⅱ对,有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]易溶于水,在定量分析中常用来配制亚铁离子的标准溶液。某化学课外小组同学设计并完成下列实验。
I.(NH4)2Fe(SO4)2·6H2O的制取
实验步骤:
①称取4.2g碎铁屑于锥形瓶中,加入10mL30%的NaOH溶液,加热煮沸-段时间。倾去碱液,水洗至中性。
②向处理过的铁屑中加入25mL3mol/LH2SO4,水浴加热至反应完全,趁热过滤。
③向滤液中加入-定体积的饱和(NH4)2SO4溶液,加热浓缩,冷却,抽滤,洗涤,干燥得产品。
(1)步骤①中加入NaOH溶液的目的是___。
(2)步骤②趁热过滤的目的是___。
(3)步骤③加热浓缩溶液时,需要的仪器有酒精灯、___、___(固定、夹持仪器除外)。
Ⅱ.(NH4)2Fe(SO4)2·6H2O和FeSO4·7H2O稳定性的对比研究
如图,在2支相同的注射器中分别装入等物质的量的两种晶体,调整2支注射器活塞使空气体积相等,用针头及胶塞封好注射器(气密性良好)。较长时间后,取出两种晶体,分别滴加2滴0.01mol/LKSCN溶液。整个过程中实验现象记录如下:
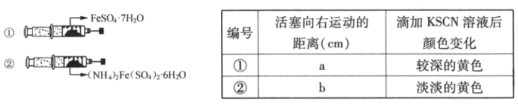
(4)判断a___b(填“>”、“<”或“=”),出现此结果的原因可能是___。
(5)判断此条件下(NH4)2Fe(SO4)2·6H2O的稳定性___(填“大于”或“小于”)FeSO4·7H2O。
Ⅲ.配制(NH4)2Fe(SO4)2溶液并标定浓度
配制(NH4)2Fe(SO4)2溶液100mL,准确量取20.00mL,置于锥形瓶中,加10mLH2SO4和邻二氮菲指示剂3~4滴,用cmol/LK2Cr2O7标准液滴定至溶液变成棕红色。消耗K2Cr2O7溶液的体积为VmL。
(6)计算(NH4)2Fe(SO4)2溶液的浓度为___ mol/L。
(7)下列操作会使所测溶液浓度偏大的是___(填标号)。
A.锥形瓶用待测溶液润洗
B.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
C.滴定过程中剧烈摇晃锥形瓶,溶液溅出
D.滴定前平视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时CH3COOH的电离平衡常数为K。该温度下向20mL0.1mol·L-1CH3COOH溶液中逐滴加入0.1mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
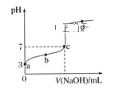
A.a点表示的溶液中c(CH3COO-)略小于10-3mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、c点表示的溶液中![]() 均等于K
均等于K
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com