
����Ŀ��I������ɫ{��Cu(H2O)4]2+}����ͭ��Һ�м����Թ����İ�ˮ����Һ��Ϊ����ɫ{��Cu(NH3)4]2+}��
(1)H2O��NH3��������ԭ�ӵ��ӻ����ͷֱ�Ϊ_______��______�������еļ��ǣ�H2O_______NH3��(������������С����)��ԭ����______��
(2)ͨ������ʵ�������֪����Cu2+����λ������H2O___ NH3(��������������С����)��
II������ԭ�ӷ�Ӧ�ѵ�ԭ�ϣ������˵Ļ�������UF4��UO2��(NH4)4 ( UO2(CO3)3���ȡ��ش��������⣺
(1)UF4��Mg��Ca��ԭ�ɵý����ˡ���̬��ԭ�ӵļ۵����Ų�ͼΪ______��
(2)����֪��(NH4)4��UO2(CO3)3] ![]() 3UO2+10NH3��+9CO2��+N2��+9H2O����(NH4)4��UO2(CO3)3]���ڵ�������������_____��
3UO2+10NH3��+9CO2��+N2��+9H2O����(NH4)4��UO2(CO3)3]���ڵ�������������_____��
a�����Ӽ� b�����ۼ� c����λ�� d��������
�� CO32-�Ŀռ乹��______ ��д�����ĵȵ�����Ļ�ѧʽ(���ӡ����Ӹ�дһ��____ ��____ ��
(3)UO2�ľ����ṹ����ͼ��ʾ��
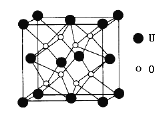
�پ�����Uԭ��λ�����ĺͶ��㣬��ԭ�������Uԭ�Ӷѻ��γɵĿ�϶�У��ڸÿ�϶����ԭ�Ӷѻ��γɵ�����Ŀռ乹��Ϊ_______(���������������������塢����������)��
����������ԭ�Ӽ����̾���Ϊa nm����UD2������ܶ�Ϊ______g��cm-3��(�г���a����ʽ���ɡ���NA��ʾ�����ӵ�������ֵ��)
���𰸡�sp3 sp3 С�� H2O����ԭ�������Թµ��Ӷԣ�NH3�е�ԭ����һ�Ե��ӹµ��Ӷԣ��µ��ӶԶԳɼ����ӶԵ��ų������ڳɼ����ӶԼ���ų���������H2O�ļ���С��NH3�ļ��� С��  abc ƽ�������� SO3 NO3- ������
abc ƽ�������� SO3 NO3- ������ ![]()
��������
I��1������VSEPR���ۺ��ӻ���������ж��ӻ���ʽ���µ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�����ϵ��Ӷ�֮��ij�����
��2������������ɸ��ȶ��������ת����
II��1����̬��ԭ�ӵĺ�������Ų�Ϊ1s22s22p5�����ݴ˿���д����۵����Ų�ͼ��
��2����(NH4)4[UO2(CO3)3]�����ӻ����笠���������֮�������Ӽ���笠���[UO2(CO3)3]4-�м�����λ�����м��Թ��ۼ���
���ü۲���ӶԻ��������ж�CO32-�Ŀռ乹�ͣ��ȵ�����ָԭ��������ȣ��۵�������Ҳ��ȵ�����
��3����Oԭ����Uԭ����ɿ�϶�У�Ӧ����8������Ӧ�ھ����ָ��8������������ģ�
��Oԭ���ھ����ָ��8������������ģ����Ӻ�Ϊ�����壻������ԭ�Ӽ����̾���Ϊa nm��������ӦΪ2a nm������![]() ���ܶȡ�
���ܶȡ�
I����1������H2O������VSEPR���ۣ�O�ļ۲���Ӷ���=2+![]() =4��������OΪsp3�ӻ�������NH3���ӣ�����VSEPR���ۣ�N�ļ۲���Ӷ���=3+
=4��������OΪsp3�ӻ�������NH3���ӣ�����VSEPR���ۣ�N�ļ۲���Ӷ���=3+![]() =4��������NΪsp3�ӻ���H2O����ԭ�������Թµ��Ӷԣ�NH3�е�ԭ����һ�Ե��ӹµ��Ӷԣ��µ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�����ϵ��Ӷ�֮��ij�����������еļ��ǣ�H2OС��NH3��
=4��������NΪsp3�ӻ���H2O����ԭ�������Թµ��Ӷԣ�NH3�е�ԭ����һ�Ե��ӹµ��Ӷԣ��µ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�����ϵ��Ӷ�֮��ij�����������еļ��ǣ�H2OС��NH3��
�ʴ�Ϊ��sp3��sp3��С�ڣ�H2O����ԭ�������Թµ��Ӷԣ�NH3�е�ԭ����һ�Ե��ӹµ��Ӷԣ��µ��ӶԶԳɼ����ӶԵ��ų������ڳɼ����ӶԼ���ų���������H2O�ļ���С��NH3�ļ��ǣ�
��2������������ɸ��ȶ��������ת���������ж�NH3��H2O��Cu2+����λ������H2O<NH3���ʴ�Ϊ��<��
II����1����̬��ԭ�ӵĺ�������Ų�Ϊ1s22s22p5�����ݴ˿���д����۵����Ų�ͼΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2����(NH4)4[UO2(CO3)3]�����ӻ����笠���������֮�������Ӽ���笠���[UO2(CO3)3]4-�м�����λ�����м��Թ��ۼ����ʴ�Ϊ��abc��
��CO32-������ԭ��Cԭ�ӵļ۲���Ӷ���=3+![]() =3������ռ乹��Ϊƽ�������Σ���CO32-Ϊ�ȵ�����ķ���ΪSO3������ΪNO3-���ʴ�Ϊ��ƽ�������Σ�SO3��NO3-��
=3������ռ乹��Ϊƽ�������Σ���CO32-Ϊ�ȵ�����ķ���ΪSO3������ΪNO3-���ʴ�Ϊ��ƽ�������Σ�SO3��NO3-��
��3������ͼ��֪��U����Ϊ���㣺![]() �����ģ�
�����ģ�![]() ��Ϊ�ĸ���Oԭ����Uԭ����ɿ�϶�У�Ӧ����8������Ӧ�ھ����ָ��8������������ģ����Ӻ�Ϊ�����壬��Ϊ�������壻
��Ϊ�ĸ���Oԭ����Uԭ����ɿ�϶�У�Ӧ����8������Ӧ�ھ����ָ��8������������ģ����Ӻ�Ϊ�����壬��Ϊ�������壻
��Oԭ���ھ����ָ��8������������ģ����Ӻ�Ϊ�����壻������ԭ�Ӽ����̾���Ϊa nm��������ӦΪ2a nm�����Ծ����ܶ�Ϊ��![]() =
=![]() g��cm-3���ʴ�Ϊ��
g��cm-3���ʴ�Ϊ��![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������������������MnO2��Ũ������ȡ�ģ���Ũ����200ml�����ܶ�Ϊ1.19g��cm-3��HCl����������Ϊ36.5%����MnO2ǡ����ȫ��Ӧ��������11.2L����������������Լ��㣺
��Ũ��������ʵ���Ũ�ȣ�___
����μӷ�Ӧ��HCl�����ʵ�����___
�۱�������HCl��������___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2L���ܱ������У�һ�������·�����ѧ��Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H= -746.4 kJ��mol-1����ʼ��Ӧʱ NO��CO��Ϊ 4 mol��10 ���Ӻ�ﵽ��ѧƽ�⣬���N2Ϊ1 mol�������йط�Ӧ���ʵ�˵���У���ȷ���ǣ� ��
N2(g)+2CO2(g) ��H= -746.4 kJ��mol-1����ʼ��Ӧʱ NO��CO��Ϊ 4 mol��10 ���Ӻ�ﵽ��ѧƽ�⣬���N2Ϊ1 mol�������йط�Ӧ���ʵ�˵���У���ȷ���ǣ� ��
A. ��Ӧǰ5�����ڣ���NO��ʾ��ƽ����Ӧ����Ϊ0.lmol��L-1��s-1
B. �ﵽƽ������{�¶ȣ�����Ӧ���ʽ���С���淴Ӧ���ʽ�����
C. �ﵽƽ���Ӧ���ʵĹ�ϵ�У�V��(CO)=2v��(N2)
D. ��������������䣬�������г���1 mol O2�������淴Ӧ���ʶ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ̽��Cl2��Br2��I2��������ǿ�������ʵ�����£�
���ϣ�ϡ��ˮ�ʻ�ɫ��Ũ��ˮ�ʺ���ɫ����ˮ���ػ�ɫ��
ʵ��� |
|
ʵ��� | ȡ���еĻ�ɫ��Һ����������KI��Һ���ټ��������Һ�� |
��1�����з�Ӧ�����ӷ���ʽ��__��
��2��ʵ����Т��͢����Եó��Ľ�����__��
��3���ټ�ͬѧ��Ϊ��ʵ���۲쵽__���ó�������Br2��I2��
����ͬѧ������ʵ����з�˼����Ϊʵ����ܳ��֤��������Br2��I2����������ʵ���
ʵ��� | ��ȡ���еĻ�ɫ��Һ�������Ȣ۲��貽�裬������������������NaBr���壬�����Ȼ�����KI��Һ�͵�����Һ�� |
����ʵ����Ŀ����__��
��4���ۺ�ʵ���͢ó�������Cl2��Br2��I2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ܳ��˵����Ӧ�Ļ�ѧ��Ӧ�Ƿ��ȷ�Ӧ����
ѡ�� | A | B | C | D |
��Ӧװ�û�ͼ�� |
|
|
|
|
ʵ�������ͼ����Ϣ | ��Ӧ��ʼ����Ͳ���������ƶ� | ��Ӧ��ʼ�ײ�Һ������Ҳ�Һ�� | �¶ȼƵ�ˮ�������� | ��Ӧ��ʼ�����������ʹ� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ϊ�ڳ�ʪ�Ŀ�����,���������һ�㱡����ˮĤ,����������Сԭ���(��ͼ��ʾ)�������й�˵����ȷ���� (����)

A.�����ĵ缫��ӦʽΪFe-3e-=Fe3+
B.������������е���ת��Ϊ��ѧ��
C.O2�������μӷ�Ӧ����OH-
D.Ϊ��������Ʒ�������ɽ�����ͭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС���õ绯ѧ��ģ�ҵ����SO2�������Ṥҵβ���е�SO2ͨ����ͼװ�ã��缫��Ϊ���Բ��ϣ�����ʵ�顣����˵����ȷ����
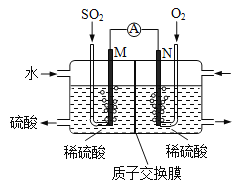
A. N������
B. ��Ӧһ��ʱ������������Һ��pH����
C. M�������ĵ缫��ӦΪSO2+2H2O-2e-=SO42-+4H+
D. ����ͬ�����£�M��N���������ĵ��������֮��Ϊ1:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ŵ����������ڻ�ѧѧ��֪ʶ�϶����ֳ���һ��ˮƽ����ʶ�����С����ӵ��������м��أ������е�ɳ�ߣ����лƽ����д�ʯ�ߣ�����ͭ�𡣡�
��.����ɳ�ߵ�ɰҲ������ɰ�ǹŴ���������Ҫԭ�ϣ�Ҳ��ʵ���Ҵ���ˮ�������IJ������Ϊ��ɰ��Ҫ�ɷ���_____��(�ѧʽ)����ʯ�ߴ�ʯҲ������д����ʯ������������ӷ���ʽ��_____��
��.��ͭ���ߣ�����ͭ��Ҳ����
�������Dz�ͤͭ����dz��������γɿ�����·��ֵ�һ�����Ͱ����Ϳ�����ͭ����Cu��Ҫ��ͭ��������(��ҪΪCuFeS2)����ʽ���ڡ��Ի�ͭ��(��Ҫ�ɷ�ΪCuFeS2������������SiO2��)Ϊԭ�ϣ�����������ͭ��ͬʱ�õ�����Ʒ�̷�(FeSO47H2O)������Ҫ������ͼ��
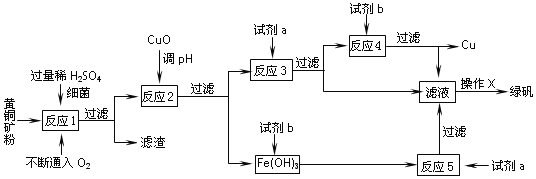
��֪���١���Ӧ1����4CuFeS2 +2H2SO4 +17O2 �T4CuSO4 +2Fe2(SO4)3 +2H2O
�ڲ���������������������ʽ��ʼ��������ȫ����ʱ��Һ��pH�����
������ | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
��ʼ����pH | 4.7 | 2.7 | 7.6 |
��ȫ����pH | 6.7 | 3.7 | 9.6 |
(1)����Ӧ1���У�ÿ����1 mol CuSO4ת�Ƶ�����Ϊ_____NA��
(2)���Լ�a����_____�����Լ�b����_____��
(3)����Ӧ2���м�CuO��pHΪ3.7��4.7��Ŀ����_____��
(4)������X��ӦΪ_____��_____�����ˡ�ϴ�ӣ����������������X������ζ����� FeSO47H2O�������ϴ��_____��
(5)��������жϡ���Ӧ5���ѽ�����ȫ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(M)������صĹ���ԭ����ͼ��ʾ������˵����ȷ����(����)
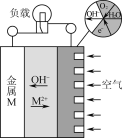
A.����M���������
B.����������ڵ�MO
C.��·��ת��2 mol���ӣ�������Լ���Ŀ���56 L
D.����ܷ�ӦΪ2M��O2��2H2O=2M(OH)2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com