
【题目】分支酸用于生化研究,可以由物质A合成.已知:连4个不相同的原子或原子团的碳原子是手性碳原子.
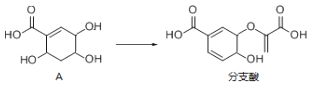
下列叙述不正确的是![]()
A.用![]() 溶液可鉴别化合物A和分支酸
溶液可鉴别化合物A和分支酸
B.化合物A中含有3个手性碳原子
C.1mol分支酸在一定条件下最多可与![]() 发生反应
发生反应
D.在浓硫酸和加热条件下,化合物A可发生消去反应生成多种有机产物
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾具有强氧化性,广泛用于化工、医药、采矿、金属治炼及环境保护领域等。KMnO4的制备是以二氧化锰(MnO2)为原料,在强碱性介质中被氧化生成墨绿色的锰酸钾(K2MnO4);然后在一定pH下K2MnO4歧化生成紫色KMnO4。回答下列问题
(1)K2MnO4的制备
实验步骤 | 现象或解释 |
①称取2.5 gKClO3固体和5.2gKOH固体置于铁坩埚中,加热熔融 | 不用瓷坩埚的原因是____________。 |
②分多次加入3gMnO2固体 | 不一次加入的原因是__________________。 |
(2)KMnO4的制备
趁热向K2MnO4溶液中加入1 mol/L H3PO4溶液,直至K2MnO4全部歧化,判断全部歧化的方法是用玻璃棒蘸取溶液于滤纸上,现象为_________________________。然后趁热过滤,将滤液倒入蒸发皿中加热到液面出现晶膜,充分冷却后过滤,在80℃烘箱中干燥3h,不选用更高温度的原因是_____________________________。
(3)产品分析
i.不同pH下产品中KMnO4含量
加入H3PO4体积/mL | 溶液的pH | 产品质量 | KMnO4质量 | KMnO4质量分数 |
10.50 | 12.48 | 2.35 | 2.05 | 87.23 |
12.50 | 11.45 | 2.45 | 2.18 | 88.98 |
14.50 | 10.89 | 2.18 | 1.87 | 85.78 |
16.50 | 10.32 | 2.28 | 1.75 | 76.75 |
18.50 | 9.44 | 2.09 | 1.48 | 70.81 |
从表格中数据分析,在歧化时选择溶液的最佳pH是________________。
ii.利用H2C2O4标准溶液测定KMnO4的纯度。测定步骤如下:
①溶液配制:称取1.000g的KMnO4固体样品,放入_____________中溶解,然后冷至室温后全部转移到100mL容量瓶中,加蒸馏水至刻度线。
②滴定:移取25 mLKMnO4溶液于锥形瓶中,加少量硫酸酸化,用0.1400mol/L的H2C2O4标准溶液滴定,发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10C02+8H2O,当溶液紫色褪色且半分钟内不变色即为终点,平行滴定3次,H2C2O4溶液的平均用量为23.90mL,则样品纯度为_______________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74×10-3 | |
下列说法不正确的是( )
A. 该反应正反应为吸热反应
B. 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C. 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D. 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)是提取铝的原料,提取铝的工艺流程如图:

请回答下列问题:
(1)过滤操作需用到的玻璃仪器除烧杯、玻璃棒外,还需要__。
(2)流程图中固体B的成分为__,流程图中试剂X为__。
(3)为验证滤液A含Fe3+,可取少量滤液A滴加__溶液,溶液显红色。
(4)通入过量的CO2时发生的化学方程式为__。
(5)现有102 t含氧化铝50%的铝土矿,理论上可炼出__t金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(g)cC(g)+dD(g)△H,根据图象判断,下列叙述正确的是( )

A.p1<p2,a+b<c+d,T1<T2,△H>0
B.p1<p2,a+b>c+d,T1>T2,△H>0
C.p1<p2,a+b<c+d,T1>T2,△H>0
D.以上答案均不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮有不同价态的氧化物,如NO、N2O3、NO2等,它们在一定条件下可以相互转化。
(1)某温度下,在一体积可变的密闭容器中充入1molN2O3,发生反应N2O3NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图象如图1所示,有关说法
正确的是____
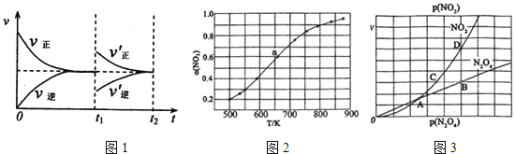
A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容积的一半,则速率~时间图象与上图相同
(2)在1000K下,在某恒容容器中发生下列反应:2NO2(g)2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。
图2中a点对应温度下。已知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2).其中,k1、k2是与反应及温度有关的常数。相应的速率﹣压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=_____;在图3标出点中,指出能表示反应达到平衡状态的两个点_____,理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:

(1)上表的6种酸进行比较,酸性最弱的是:_____;HCOO-、S2-、HSO3-三种离子中,最难结合H+的是__________。
(2)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:_________。
(3)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:___。
(4)下列离子方程式书写正确的是________。
A.HNO2+HS-=NO2-+H2S↑
B.2HCOOH+SO32-=2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32-
D.H2SO3+SO32-=2HSO3-
E.H2C2O4+NO2-=HC2O4-+HNO2
(5)将少量的SO2通入Na2C2O4溶液,写出离子方程式___。
(6)已知HX为一元弱酸。HX的电离常数为5.5×10﹣8。某混合溶液中含有4molNaX、2molNa2CO3和1molNaHCO3。往溶液中通入3molCO2气体,充分反应后,气体全部被吸收,计算某些物质的量:Na2CO3______、NaHCO3______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验的说法正确的是![]()
实验目的 | 实验方案 | |
A | 除去苯中溶有的苯酚 | 取苯与苯酚的混合液,加入浓溴水,过滤 |
B | 证明 | 将 |
C | 分离 | 将混合液倒入过滤器中过滤 |
D | 酸性: |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
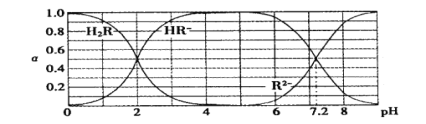
A.H2R是二元弱酸,其Ka1=1×10-2
B.当溶液恰好呈中性时,c( Na + )=2c ( R2- ) + c( HR- )
C.NaHR在溶液中水解倾向大于电离倾向
D.含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com