
【题目】已知热化学方程式:
①C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)![]() CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH3=-285.8 kJ·mol-1
H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)![]() C2H2(g)的ΔH为( )
C2H2(g)的ΔH为( )
A. -228.2 kJ·mol-1B. +228.2 kJ·mol-1
C. +1301.0 kJ·mol-1D. +621.7 kJ·mol-1
科目:高中化学 来源: 题型:
【题目】复旦大学研发的一种新型水锂电池,一极采用复合膜包裹的金属锂,另一极采用锰酸锂(LiMn2O4),以0.5mol·L-1Li2SO4水溶液作电解质,安全性能和成本较现有的锂离子电池都具有明显的优势。下列有关该电池的说法不正确的是( )

A.电极a是负极,电极b是正极
B.工作时电池的总反应为:LiMn2O4+Li=Li2Mn2O4
C.放电时,溶液中Li+从a向b迁移
D.电池放电时的阳极反应式为:Li2Mn2O4e-=LiMn2O4+Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
(1)将褐色硬块处理成粉末状。研究小组首先排除了含有单质Al杂质的可能性,实验方法是________,证明不含单质铝的现象是_____________。
(2)该褐色硬块的组成基本确定为Fe、Fe2O3,Al2O3。请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20% KSCN、3 mol·L-1NaOH、3 mol·L-1HCl、3 mol·L-1HNO3、3 mol·L-1CuSO4、0.01 mol·L-1KMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。_____________。
实验操作 | 预期现象和结论 |
步骤1: | |
步骤2: | |
步骤3: | |
步骤4: |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:![]() .
.
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________.
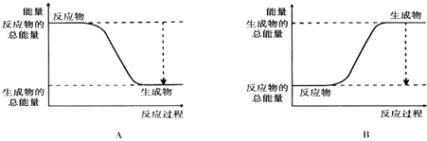
(3)从断键和成键的角度分析上述反应中能量的变化.
化学键 |
|
|
|
键能 |
|
|
|
请填写下表:
化学键 | 填“吸收”或“放出”能量 | 能量变化 | |
拆开化学键 |
| ①________ | ④________ |
| |||
形成化学键 |
| ②________ | ⑤________ |
总能量变化 | ③________ | ⑥________ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示。且W与X、Y、Z均可形成电子数相等的分子,![]() 常温常压下为液体。下列说法不正确的是( )
常温常压下为液体。下列说法不正确的是( )
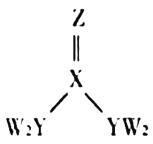
A.X、Y的简单氢化物的稳定性:![]()
B.W、Y、Z三种元素不能形成离子化合物
C.![]() 甲分子中存在
甲分子中存在![]() 键
键
D.Y元素的简单氢化物能使湿润的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、![]() 溶液,所得沉淀溶解平衡图像如图所示(不考虑
溶液,所得沉淀溶解平衡图像如图所示(不考虑![]() 的水解)。下列叙述不正确的是( )
的水解)。下列叙述不正确的是( )
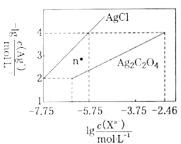
A.n点表示![]() 的不饱和溶液
的不饱和溶液
B.![]() 的值等于10-9.75
的值等于10-9.75
C.![]() 的平衡常数为109.04
的平衡常数为109.04
D.向![]() 的混合液中滴入AgNO3溶液时,先生成
的混合液中滴入AgNO3溶液时,先生成![]() 沉淀
沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
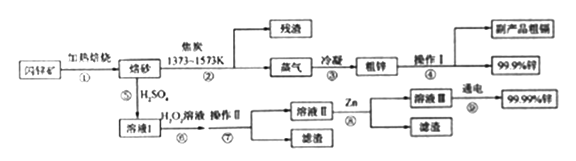
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点(K) | 693 | 1812 | 1356 | 594 |
沸点(K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH | 完全沉淀 pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗 镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断正确的是
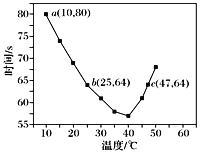
A.40 ℃之前,温度升高反应速率减慢,变蓝时间变长
B.40 ℃之后溶液变蓝的时间随温度的升高变短
C.图中b、c两点对应的NaHSO3的反应速率相等
D.图中a点对应的NaHSO3的反应速率为5.0×10-5mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:
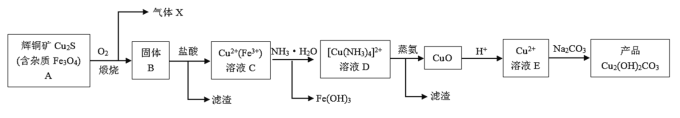
已知:Cu(OH)2溶于氨水形成[Cu(NH3)4]2+
根据以上工艺流程,下列说法不正确的是( )
A.为实现溶液C到溶液D的转化,加入过量的NH3H2O后过滤即可
B.溶液E和碳酸钠混合方式不同对产品的成分没有影响
C.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因可能是游离的Cu2+浓度太低
D.蒸氨过程发生总反应的化学方程式为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com