
【题目】短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示。且W与X、Y、Z均可形成电子数相等的分子,![]() 常温常压下为液体。下列说法不正确的是( )
常温常压下为液体。下列说法不正确的是( )
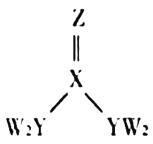
A.X、Y的简单氢化物的稳定性:![]()
B.W、Y、Z三种元素不能形成离子化合物
C.![]() 甲分子中存在
甲分子中存在![]() 键
键
D.Y元素的简单氢化物能使湿润的红色石蕊试纸变蓝
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
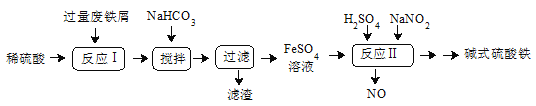
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.0 | 5.9 | 3.7 |
完全沉淀 | 3.5 | 8.4 | 4.7 |
请回答下列问题:
(1)该工艺中“搅拌”的作用是__,写出反应I中发生氧化还原反应的离子方程式__。
(2) “滤渣”的主要成分是__(填化学式),加入适量NaHCO3的目的是调节pH在__范围内。
(3)反应Ⅱ中加入NaNO2的离子方程式为__,在实际生产中,可以同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6L(标况),则理论上相当于节约NaNO2(Mr=69)用量__g。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解为Fe2(OH)![]() 聚合离子,该水解反应的离子方程式为__。
聚合离子,该水解反应的离子方程式为__。
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:取25.00mL溶液,稀释到250mL,准确量取20.00mL于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知:2Fe3++2I-==2Fe2++I2、2![]() +I2==2I-+
+I2==2I-+![]()
则溶液中铁元素的总含量为__g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是人类获取能量的中重要途径
(1)液化气是一种重要的家庭燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是(______)
A.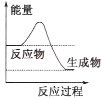 B.
B.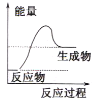 C.
C.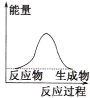
(2)"冰袋"可用于短时间保鲜食物。将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间那部分,使两种晶体分开,做成“冰袋”。使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温。由此判断:碳酸钠晶体与硝酸铵晶体的总能量_____(填“高于”或“低于”)反应后生成物的总能量
(3)化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化。比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为______和_____;人们普遍使用的干电池工作时是将化学能转化为_____
(4)下列反应中,属于放热反应的是____,属于吸热反应的是_____。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ②燃烧木炭取暖
③炸药爆炸 ④酸与碱的中和反应
⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(5)已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496kJ的能量,形成水分子中的1molH—O键要放出463 kJ的能量,试计算2H2+O2=2H2O反应中的ΔH=___kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 世纪
世纪![]() 年代,
年代,![]() 和
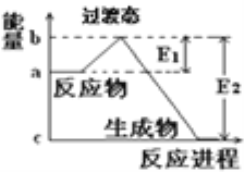
和![]() 在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是
在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 过程中的能量变化示意图,说明这个反应是________(填“吸热”或“放热”)反应,
过程中的能量变化示意图,说明这个反应是________(填“吸热”或“放热”)反应,![]() 和
和![]() 的总能量________(填“
的总能量________(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)![]() 和
和![]() 的总能量.
的总能量.
(2)在某体积为![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]()
![]()
![]() ,
,![]() 时,测得容器中
时,测得容器中![]() 的物质的量为
的物质的量为![]() ,则:
,则:
①该段时间内,用![]() 表示的平均反应速率为________.
表示的平均反应速率为________.
②假设此反应在![]() 时达到平衡,则此时容器内气体的总物质的量为________.
时达到平衡,则此时容器内气体的总物质的量为________.
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是________
A.容器内气体的质量保持变
B.NO2的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变
D.NO2的消耗速率与![]() 的消耗速率相等
的消耗速率相等
E.容器内气体的物质的量保持不变.
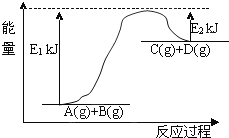
(3)已知某反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
该反应是________反应,该反应的△H=________,1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)![]() CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH3=-285.8 kJ·mol-1
H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)![]() C2H2(g)的ΔH为( )
C2H2(g)的ΔH为( )
A. -228.2 kJ·mol-1B. +228.2 kJ·mol-1
C. +1301.0 kJ·mol-1D. +621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用反应TiO2(s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4装置如图所示:
TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4装置如图所示:
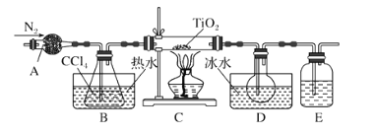
有关物质的性质如下表
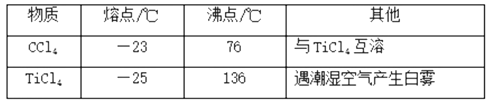
下列说法正确的是( )
A.A和E分别盛装碱石灰和氢氧化钠溶液
B.点燃C处酒精灯后再往A中通入N2
C.A装置的名称是冷凝管
D.分离D中的液态混合物,所采用操作的名称是分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )
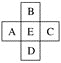
A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为________。
(2)元素Y的最高价氧化物的结构式为__________,其中一种同位素可测定文物年代,这种同位素的符号是________。
(3)元素Z能与氢元素形成-1价阴离子为_________,该阴离子的电子总数是________。
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为___________。
(5)ZW3常温下呈液态,可与水反应生成一种具有漂白性的酸和一种碱性气体,反应的化学方程式为_______。
(6)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是_______(用酸的分子式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com