
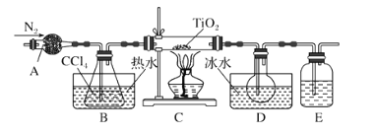
【题目】实验室利用反应TiO2(s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4装置如图所示:
TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4装置如图所示:
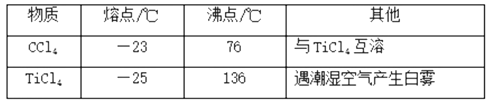
有关物质的性质如下表
下列说法正确的是( )
A.A和E分别盛装碱石灰和氢氧化钠溶液
B.点燃C处酒精灯后再往A中通入N2
C.A装置的名称是冷凝管
D.分离D中的液态混合物,所采用操作的名称是分馏
【答案】D
【解析】
仪器A为干燥管,因为TiCl4遇到水蒸气会水解,所以E中可以用浓硫酸来隔离空气;水浴加热条件下,装置B可提供稳定的四氯化碳气流,在C中发生TiO2(s)+CCl4(g)![]() TiCl4(g)+CO2(g),加热时先排出装置中的空气且C处需要稳定四氯化碳气流再加热,终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2,D中得到CCl4、TiCl4的混合物,可用蒸馏的方法分离,以此解答该题。
TiCl4(g)+CO2(g),加热时先排出装置中的空气且C处需要稳定四氯化碳气流再加热,终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2,D中得到CCl4、TiCl4的混合物,可用蒸馏的方法分离,以此解答该题。
A.由上述分析可知,A中为碱石灰,E中为浓硫酸,A错误;
B.加热时先排出装置中的空气且C处需要稳定四氯化碳气流再加热,则先往A中通入N2,再点燃C处酒精灯,B错误;
C.根据装置图可知A装置的名称是干燥管,C错误;
D.由表格中信息可知D中液态混合物有CCl4、TiCl4,二者互溶,沸点相差很大,可用蒸馏或分馏的方法分离,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为____________。
②下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)下表为某同学所测25℃时,甲、乙两种溶液的pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =___________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲_____乙。
③甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲_____乙。
(3)已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度……今有HA、H2B、H3C三种弱酸,根据“较强酸 + 较弱酸盐 = 较强酸盐 + 较弱酸”的反应规律,它们之间能发生下列反应:
a.HA + HC2-(少量) = A-+ H2C-
b.H2B(少量) + 2A- = B2- + 2HA
c.H2B(少量) + H2C- = HB-+ H3C
回答下列问题:
①相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________。
②下列反应的离子方程式正确的是____________。
A.H3C +3A- = 3HA + C3- B.HB- +A- = HA + B2-
③完成下列反应的离子方程式:
a.H3C + OH-(过量)——__________________;b.HA(过量) + C3- ——_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 稀醋酸与稀氢氧化钠溶液发生中和反应的热化学方程式为CH3COOH (aq) + NaOH (aq) = CH3COONa(aq) + H2O(l) ΔH=![]() 57.3kJ/mol
57.3kJ/mol
B. 在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热
C. 未来氢气作为新能源的其中一个优点是充分燃烧的产物不污染环境
D. 升高温度或加入催化剂,可以改变化学反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示。且W与X、Y、Z均可形成电子数相等的分子,![]() 常温常压下为液体。下列说法不正确的是( )
常温常压下为液体。下列说法不正确的是( )
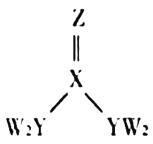
A.X、Y的简单氢化物的稳定性:![]()
B.W、Y、Z三种元素不能形成离子化合物
C.![]() 甲分子中存在
甲分子中存在![]() 键
键
D.Y元素的简单氢化物能使湿润的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
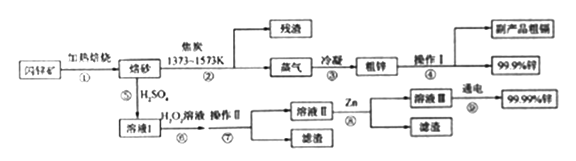
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点(K) | 693 | 1812 | 1356 | 594 |
沸点(K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH | 完全沉淀 pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗 镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在![]() 密闭容器中放入
密闭容器中放入![]() ,在一定温度进行如下反应:
,在一定温度进行如下反应:![]()
容器内气体总压强(P)与起始压强![]() 的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
时间 | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | |
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题
(1)下列能提高A的转化率的是_______
A.升高温度 B.体系中通入A气体
C.将D的浓度减小 D.通入稀有气体![]() ,使体系压强增大到原的5倍
,使体系压强增大到原的5倍
(2)该反应的平衡常数的表达式K_______,前2小时C的反应速率是_________![]() ;
;
(3)平衡时A的转化率___________,C的体积分数__________(均保留两位有效数字)
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的物质的量取值范围![]() ______
______![]()
Ⅱ.已知乙酸是一种重要的化工原料,该反应所用的原理与工业合成乙酸的原理类似;常温下,将![]() 溶于水配成
溶于水配成![]() 溶液,向其中滴加等体积的
溶液,向其中滴加等体积的![]() 的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数
的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数![]() ___________
___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_______________________________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ.
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量.
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量.
③b 与a、c、d的数学关系式是_____________.
II、利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm3,又知中和反应后生成溶液的比热容c=4.18 J·g1·℃1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________kJ·mol1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成药物氨鲁米特。
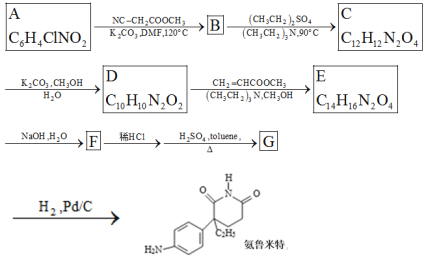
①A到B为取代反应,B的化学式为C10H8N2O4,B到C是乙基化反应。
②C到D的反应包括水解、脱去羧基(CO2 )两步反应。
③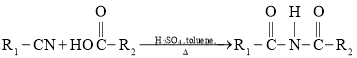
请回答:
(1)化合物A的结构简式________。
(2)下列说法不正确的是________。
A.化合物B能发生加成反应 B.化合物C能发生消去反应 C.化合物G具有碱性且在酸性条件下能水解生成CO2 D.氨鲁米特的分子式是C13H16N2O2
(3)设计化合物A转变为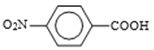 的合成路线(用流程图表示,试剂任选)________。
的合成路线(用流程图表示,试剂任选)________。
(4)写出E→F的化学方程式________。
(5)写出化合物D可能的同分异构体的结构简式________,须同时符合:①1H-NMR谱表明分子中有4种氢原子,IR谱显示仅有苯环无其他环状结构,含氨基-NH2;②该物质能水解,且能发生银镜反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com