
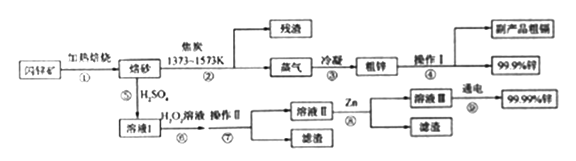
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点(K) | 693 | 1812 | 1356 | 594 |
沸点(K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH | 完全沉淀 pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗 镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。
【答案】2ZnS + 3O2 ![]() 2ZnO + 2SO2 ZnO(s) + C(s)
2ZnO + 2SO2 ZnO(s) + C(s) ![]() Zn(g) + CO (g) △H = + a kJ/mol 蒸馏 1040 K 3.2 < pH < 5.9 除去溶液中的Fe3+ 2ZnSO4 + 2H2O
Zn(g) + CO (g) △H = + a kJ/mol 蒸馏 1040 K 3.2 < pH < 5.9 除去溶液中的Fe3+ 2ZnSO4 + 2H2O ![]() 2Zn + O2↑+ 2H2SO4 48.5%
2Zn + O2↑+ 2H2SO4 48.5%
【解析】
(1)本题考查化学反应方程式的书写,根据闪锌矿的主要成分,因此反应①的主要反应是2ZnS+3O2![]() 2ZnO+2SO2,金属单质转化成相应的氧化物;(2)本题考查热化学反应方程式的书写,反应的方程式为ZnO+C
2ZnO+2SO2,金属单质转化成相应的氧化物;(2)本题考查热化学反应方程式的书写,反应的方程式为ZnO+C![]() CO+Zn,生成1molCO时,吸收热量akJ,因此热化学反应方程式为:ZnO(s) + C(s)
CO+Zn,生成1molCO时,吸收热量akJ,因此热化学反应方程式为:ZnO(s) + C(s) ![]() Zn(g) + CO (g) △H = + a kJ/mol;(3)本题考查物质的分离和提纯,反应②,焦炭作还原剂,把金属从其氧化物中还原出来,根据金属的熔沸点,②反应的温度是1373~1573K,此时Zn和Cd是蒸气,粗锌的成分是Zn和Cd,利用其沸点不同,对粗锌加热,温度控制在1040K左右,让Cd转化成蒸气,达到分离的目的,因此此方法是蒸馏;(4)本题考查物质的除杂,根据表格II的数据,以及流程图,锌元素以离子形式存在,因此pH控制在3.2到5.9之间,目的是除去Fe3+;(5)根据流程图,电解得到99.99%的锌单质,采用的方法是电解,因此反应方程式为2ZnSO4 + 2H2O
Zn(g) + CO (g) △H = + a kJ/mol;(3)本题考查物质的分离和提纯,反应②,焦炭作还原剂,把金属从其氧化物中还原出来,根据金属的熔沸点,②反应的温度是1373~1573K,此时Zn和Cd是蒸气,粗锌的成分是Zn和Cd,利用其沸点不同,对粗锌加热,温度控制在1040K左右,让Cd转化成蒸气,达到分离的目的,因此此方法是蒸馏;(4)本题考查物质的除杂,根据表格II的数据,以及流程图,锌元素以离子形式存在,因此pH控制在3.2到5.9之间,目的是除去Fe3+;(5)根据流程图,电解得到99.99%的锌单质,采用的方法是电解,因此反应方程式为2ZnSO4 + 2H2O ![]() 2Zn + O2↑+ 2H2SO4;(6)湿法炼锌中操作⑧加入锌单质,因此湿法炼锌得到锌不完全来自于闪锌矿,因此计算质量分数用火法炼锌中得到锌进行计算,根据锌元素守恒,因此ZnS的质量分数为65×97/(65×200)×100%=48.5%。
2Zn + O2↑+ 2H2SO4;(6)湿法炼锌中操作⑧加入锌单质,因此湿法炼锌得到锌不完全来自于闪锌矿,因此计算质量分数用火法炼锌中得到锌进行计算,根据锌元素守恒,因此ZnS的质量分数为65×97/(65×200)×100%=48.5%。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】已知:①CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
②CO(g)+![]() O2(g)===CO2(g) ΔH2=-b kJ·mol-1
O2(g)===CO2(g) ΔH2=-b kJ·mol-1
③H2(g)+![]() O2(g)===H2O(g) ΔH3=-c kJ·mol-1
O2(g)===H2O(g) ΔH3=-c kJ·mol-1
④H2(g)+![]() O2(g)===H2O(l) ΔH4=-d kJ·mol-1
O2(g)===H2O(l) ΔH4=-d kJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知ΔH3>ΔH4
B. H2的燃烧热为c kJ·mol-1
C. CH3OH(g)===CO(g)+2H2(g) ΔH=( a- b-2c)kJ·mol-1
D. 当CO和H2的物质的量之比为1∶2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或模型正确的是
A. 苯分子的比例模型:
B. CO2的电子式:![]()
C. Cl-离子的结构示意图:
D. 乙烯的结构式:CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2分子构型为V形 B. ClO3—的空间构型为平面三角形
C. SF6中有4对完全相同的成键电子对 D. SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族。W 与X 可形成共价化合物WX2.Y原子的内层电子总数是其最外层电子数的2.5 倍。下列叙述中不正确的是
A. WX2分子中所有原子最外层都为8 电子结构
B. 简单气态氢化物的沸点W的比X的低
C. WX2是以极性键结合成的非极性分子
D. 原子半径大小顺序为X <W<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 1 mol O2的质量是32 g/mol
B. 对原子而言,摩尔质量就是相对原子质量
C. H2的摩尔质量是2 g
D. H+的摩尔质量1 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
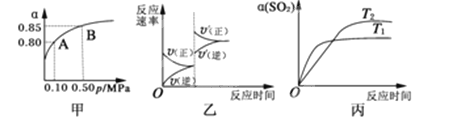
A. 由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B. 由图甲推断,A点对应温度下该反应的平衡常数为800(L·mol-1)
C. 达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D. 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
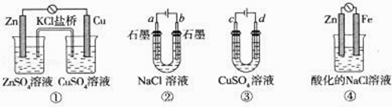
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 滴有酚酞溶液的装置②在电解过程中,b极先变红
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com