
ΓΨΧβΡΩΓΩΦν ΫΝρΥαΧζ[Fe(OH)SO4] «“Μ÷÷”Ο”ΎΈέΥ°¥ΠάμΒΡ–¬–ΆΗΏ–ß–θΡΐΦΝΘ§‘Ύ“Ϋ“©…œ“≤Ω…”Ο”Ύ÷ΈΝΤœϊΜ·–‘άΘ―ώ≥ω―ΣΓΘΙΛ“Β…œάϊ”ΟΖœΧζ–ΦΘ®Κ§…ΌΝΩ―θΜ·¬ΝΓΔ―θΜ·ΧζΒ»Θ©…ζ≤ζΦν ΫΝρΥαΧζΒΡΙΛ“’Νς≥Χ»γΆΦΘΚ
“―÷ΣΘΚ≤ΩΖ÷―τάκΉ”“‘«β―θΜ·Έο–Έ Ϋ≥ΝΒμ ±»ή“ΚΒΡpHΦϊœ¬±μΘΚ
≥ΝΒμΈο | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
ΩΣ Φ≥ΝΒμ | 2.0 | 5.9 | 3.7 |
Άξ»Ϊ≥ΝΒμ | 3.5 | 8.4 | 4.7 |
«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)ΗΟΙΛ“’÷–ΓΑΫΝΑηΓ±ΒΡΉς”Ο «__Θ§–¥≥ωΖ¥”ΠI÷–ΖΔ…ζ―θΜ·ΜΙ‘≠Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ__ΓΘ
(2) ΓΑ¬Υ‘ϋΓ±ΒΡ÷ς“Σ≥…Ζ÷ «__Θ®ΧνΜ·―ß ΫΘ©Θ§Φ”»κ ΝΩNaHCO3ΒΡΡΩΒΡ «ΒςΫΎpH‘Ύ__ΖΕΈßΡΎΓΘ
(3)Ζ¥”ΠΔρ÷–Φ”»κNaNO2ΒΡάκΉ”ΖΫ≥Χ ΫΈΣ__Θ§‘Ύ ΒΦ …ζ≤ζ÷–Θ§Ω…“‘Ά§ ±Ά®»κO2“‘Φθ…ΌNaNO2ΒΡ”ΟΝΩΘ§»τ≤Έ”κΖ¥”ΠΒΡO2”–5.6LΘ®±ξΩωΘ©Θ§‘ράμ¬έ…œœύΒ±”ΎΫΎ‘ΦNaNO2Θ®Mr=69Θ©”ΟΝΩ__gΓΘ
(4)Φν ΫΝρΥαΧζ»ή”ΎΥ°Κσ…ζ≥…ΒΡFe(OH)2+άκΉ”Ω…≤ΩΖ÷Υ°ΫβΈΣFe2(OH)![]() ΨέΚœάκΉ”Θ§ΗΟΥ°ΫβΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ__ΓΘ
ΨέΚœάκΉ”Θ§ΗΟΥ°ΫβΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ__ΓΘ
(5)ΈΣ≤βΕ®Κ§Fe2+ΚΆFe3+»ή“Κ÷–Χζ‘ΣΥΊΒΡΉήΚ§ΝΩΘ§ Β―ι≤ΌΉς»γœ¬ΘΚ»Γ25.00mL»ή“ΚΘ§œΓ ΆΒΫ250mLΘ§ΉΦ»ΖΝΩ»Γ20.00mL”Ύ¥χ»ϊΉΕ–ΈΤΩ÷–Θ§Φ”»κΉψΝΩH2O2Θ§ΒςΫΎpH<2Θ§Φ”»»≥ΐ»ΞΙΐΝΩH2O2ΘΜΦ”»κΙΐΝΩKI≥δΖ÷Ζ¥”ΠΚσΘ§‘Ό”Ο0.01000molΓΛL-1Na2S2O3±ξΉΦ»ή“ΚΒΈΕ®÷Ν÷’ΒψΘ§œϊΚΡ±ξΉΦ»ή“Κ20.00mLΓΘ“―÷ΣΘΚ2Fe3++2I-==2Fe2++I2ΓΔ2![]() +I2==2I-+
+I2==2I-+![]()
‘ρ»ή“Κ÷–Χζ‘ΣΥΊΒΡΉήΚ§ΝΩΈΣ__gΓΛL-1ΓΘ
ΓΨ¥πΑΗΓΩΦ”ΩλΜ·―ßΖ¥”ΠΥΌ¬ Fe+2H+=Fe2++H2ΓϋΘ§Fe+2Fe3+=3Fe2+ Al(OH)3 4.7ΓήpHΘΦ5.9Μρ4.7~5.9 2H++Fe2++![]() =Fe3++NOΓϋ+H2O 69 2Fe(OH)2++2H2O
=Fe3++NOΓϋ+H2O 69 2Fe(OH)2++2H2O![]()
![]() +2H+ 5.6
+2H+ 5.6
ΓΨΫβΈωΓΩ
ΖœΧζ–Φ(Κ§…ΌΝΩ―θΜ·¬ΝΓΔ―θΜ·ΧζΒ»)÷–Φ”»κœΓΝρΥαΘ§―θΜ·¬ΝΓΔ―θΜ·Χζ»ήΫβ…ζ≥…ΝρΥα¬ΝΚΆΝρΥαΧζΘ§ΝρΥαΧζ”κΧζ–ΦΖ¥”Π…ζ≥…ΝρΥα―«ΧζΘ§Χζ–Φ”κœΓΝρΥαΖ¥”Π…ζ≥…ΝρΥα―«ΧζΚΆ«βΤχΘΜΦ”»κNaHCO3ΫΝΑηΚσΘ§NaHCO3”κœΓΝρΥαΉς”ΟΘ§¥”ΕχΦθ…Ό»ή“Κ÷–ΒΡΝρΥα≈®Ε»Θ§‘ω¥σ»ή“ΚΒΡpHΘ§ ΙAl3+Υ°Ϋβ…ζ≥…Al(OH)3≥ΝΒμΘΜΙΐ¬ΥΚσΘ§ΥυΒΟ¬Υ“ΚΈΣFeSO4»ή“ΚΘΜΦ”»κH2SO4ΓΔNaNO2»ή“ΚΘ§”κFe2+ΖΔ…ζ―θΜ·ΜΙ‘≠Ζ¥”ΠΘ§…ζ≥…Fe3+ΓΔNOΚΆH2OΘΜΉνΚσΫΪ»ή“ΚΫχ––¥ΠάμΘ§±ψΩ…ΜώΒΟΦν ΫΝρΥαΧζΓΘ
(1)ΗΟΙΛ“’÷–ΓΑΫΝΑηΓ±Ω…‘ω¥σΖ¥”ΠΈοΦδΒΡΫ”¥ΞΟφΜΐΘ§”–άϊ”ΎΖ¥”ΠΒΡΖΔ…ζΘ§Υυ“‘ΤδΉς”Ο «Φ”ΩλΜ·―ßΖ¥”ΠΥΌ¬ Θ§Ζ¥”ΠI÷–Θ§ΖΔ…ζΒΡ―θΜ·ΜΙ‘≠Ζ¥”ΠΈΣΝρΥαΧζ”κΧζ–ΦΖ¥”Π…ζ≥…ΝρΥα―«ΧζΘ§Χζ–Φ”κœΓΝρΥαΖ¥”Π…ζ≥…ΝρΥα―«ΧζΚΆ«βΤχΘ§άκΉ”ΖΫ≥Χ ΫΈΣFe+2H+=Fe2++H2ΓϋΓΔFe+2Fe3+=3Fe2+ΓΘ¥πΑΗΈΣΘΚΦ”ΩλΜ·―ßΖ¥”ΠΥΌ¬ ΘΜFe+2H+=Fe2++H2ΓϋΓΔFe+2Fe3+=3Fe2+ΘΜ
(2) ¥”“‘…œΖ÷ΈωΩ…÷ΣΘ§ΓΑ¬Υ‘ϋΓ±ΒΡ÷ς“Σ≥…Ζ÷ «Al(OH)3Θ§Φ”»κ ΝΩNaHCO3ΒΡΡΩΒΡ «ΒςΫΎpHΘ§ ΙAl3+»Ϊ≤Ω…ζ≥…≥ΝΒμΘ§ΒΪ≤ΜΡή»ΟFe2+…ζ≥…≥ΝΒμΘ§Υυ“‘”Π‘Ύ4.7ΓήpHΘΦ5.9Μρ4.7~5.9ΖΕΈßΡΎΓΘ¥πΑΗΈΣΘΚAl(OH)3ΘΜ4.7ΓήpHΘΦ5.9Μρ4.7~5.9ΘΜ
(3)Ζ¥”ΠΔρ÷–Φ”»κNaNO2Θ§ «ΈΣΝΥΫΪFe2+―θΜ·ΈΣFe3+Θ§Ά§ ±![]() ±ΜΜΙ‘≠ΈΣNOΘ§άκΉ”ΖΫ≥Χ ΫΈΣ2H++Fe2++
±ΜΜΙ‘≠ΈΣNOΘ§άκΉ”ΖΫ≥Χ ΫΈΣ2H++Fe2++![]() =Fe3++NOΓϋ+H2OΘΜ“άΨίΒΟ ßΒγΉ” ΊΚψΘ§O2ΓΣΓΣ4NaNO2Θ§»τ≤Έ”κΖ¥”ΠΒΡO2”–5.6LΘ®±ξΩωΘ©Θ§‘ράμ¬έ…œœύΒ±”ΎΫΎ‘ΦNaNO2Θ®Mr=69Θ©”ΟΝΩΈΣ
=Fe3++NOΓϋ+H2OΘΜ“άΨίΒΟ ßΒγΉ” ΊΚψΘ§O2ΓΣΓΣ4NaNO2Θ§»τ≤Έ”κΖ¥”ΠΒΡO2”–5.6LΘ®±ξΩωΘ©Θ§‘ράμ¬έ…œœύΒ±”ΎΫΎ‘ΦNaNO2Θ®Mr=69Θ©”ΟΝΩΈΣ![]() =69gΓΘ¥πΑΗΈΣΘΚ2H++Fe2++
=69gΓΘ¥πΑΗΈΣΘΚ2H++Fe2++![]() ==Fe3++NOΓϋ+H2OΘΜ69gΘΜ
==Fe3++NOΓϋ+H2OΘΜ69gΘΜ
(4)Φν ΫΝρΥαΧζ»ή”ΎΥ°Κσ…ζ≥…ΒΡFe(OH)2+άκΉ”Ω…≤ΩΖ÷Υ°ΫβΈΣFe2(OH)![]() ΨέΚœάκΉ”Θ§ΗΟΥ°ΫβΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ2Fe(OH)2++2H2O
ΨέΚœάκΉ”Θ§ΗΟΥ°ΫβΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ2Fe(OH)2++2H2O![]()
![]() +2H+ΓΘ¥πΑΗΈΣΘΚ2Fe(OH)2++2H2O
+2H+ΓΘ¥πΑΗΈΣΘΚ2Fe(OH)2++2H2O![]()
![]() +2H+ΘΜ
+2H+ΘΜ
(5)”…Ζ¥”Π2Fe3++2I-=2Fe2++I2ΓΔ2![]() +I2=2I-+
+I2=2I-+![]() Θ§Ω…ΒΟΙΊœΒ ΫΘΚFe3+ΓΣΓΣ
Θ§Ω…ΒΟΙΊœΒ ΫΘΚFe3+ΓΣΓΣ![]() Θ§
Θ§
‘ρ»ή“Κ÷–Χζ‘ΣΥΊΒΡΉήΚ§ΝΩΈΣ![]() =5.6gΓΛL-1ΓΘ¥πΑΗΈΣΘΚ5.6ΓΘ
=5.6gΓΛL-1ΓΘ¥πΑΗΈΣΘΚ5.6ΓΘ


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗυΨίœ¬Ν– Β―ι≤ΌΉςΚΆœ÷œσΥυΒΟΒΫΒΡΫα¬έ’ΐ»ΖΒΡ «( )
―Γœν | Β―ι≤ΌΉςΚΆœ÷œσ | Ϋα¬έ |
A | ”ΟΫύΨΜΒΡ≤§ΥΩ’Κ»ΓΡ≥ ≥―Έ ‘―υΘ§‘ΎΨΤΨΪΒΤΜπ―φ…œΉΤ…’Θ§Μπ―φœ‘ΜΤ…Ϊ | ΥΒΟςΗΟ ≥―Έ ‘―υ≤ΜΚ§ |
B |
|
|
C | œρΡ≥»ή“Κ÷–ΒΈΦ” | »ή“Κ÷–Κ§ |
D | ΫΪ ·ά·”Ά’τΤχΆ®Ιΐ≥ψ»»ΒΡΥι¥…Τ§Ζ÷ΫβΒΟΒΫΒΡΤχΧεΆ®»κδεΒΡΥΡ¬»Μ·ΧΦ»ή“ΚΘ§δεΒΡΥΡ¬»Μ·ΧΦ»ή“ΚΆ …Ϊ | Ζ÷Ϋβ≤ζΈο÷–Κ§““œ© |
A.AB.BC.CD.D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩNOΓΔSO2 «¥σΤχΈέ»ΨΈοΒΪ”÷”–Ή≈÷Ί“Σ”ΟΆΨΓΘ
IΘ°“―÷ΣΘΚN2 (g) + O2(g) ΘΫ 2NO (g) ΠΛH1= 180.5kJΓΛmol1
C(s) + O2(g) ΘΫ CO2(g) ΠΛH2 = 393.5kJΓΛmol1
2C(s) + O2(g) ΘΫ2CO(g) ΠΛH3 =221.0kJΓΛmol1
Θ®1Θ©Ρ≥Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐ±μ¥ο ΫΈΣK=![]() , ¥ΥΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣΘΚ_________
, ¥ΥΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣΘΚ_________
Θ®2Θ©œρΨχ»»Κψ»ίΟή±’»ίΤς÷–≥δ»κΒ»ΝΩΒΡNOΚΆCOΫχ––Ζ¥”ΠΘ§Ρή≈–ΕœΖ¥”Π“―¥οΒΫΜ·―ßΤΫΚβΉ¥Χ§ΒΡ «_______Θ®Χν–ρΚ≈Θ©ΓΘ
aΘ°»ίΤς÷–ΒΡ―Ι«Ω≤Μ±δ bΘ°2v’ΐ(CO)=vΡφ(N2)
cΘ°ΤχΧεΒΡΤΫΨυœύΕ‘Ζ÷Ή”÷ ΝΩ±Θ≥÷34.2≤Μ±δ dΘ°ΗΟΖ¥”ΠΤΫΚβ≥Θ ΐ±Θ≥÷≤Μ±δ
eΘ°NOΚΆCOΒΡΧεΜΐ±»±Θ≥÷≤Μ±δ
IIΘ°Θ®3Θ©SO2Ω…”Ο”Ύ÷ΤNa2S2O3ΓΘΈΣΧΫΨΩΡ≥≈®Ε»ΒΡNa2S2O3ΒΡΜ·―ß–‘÷ Θ§Ρ≥Ά§―ß…ηΦΤ»γœ¬ Β―ιΝς≥ΧΘΚ

”ΟάκΉ”ΖΫ≥Χ Ϋ±μ ΨNa2S2O3»ή“ΚΨΏ”–Φν–‘ΒΡ‘≠“ρ___________ΓΘNa2S2O3”ꬻհƥ”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «__________ΓΘ
Θ®4Θ©Κ§SO2ΒΡ―ΧΤχΩ…”ΟNa2SO3»ή“ΚΈϋ ’ΓΘΩ…ΫΪΈϋ ’“ΚΥΆ÷ΝΒγΫβ≤έ‘Ό…ζΚσ―≠ΜΖ Ι”ΟΓΘ‘Ό…ζΒγΫβ≤έ»γΆΦΥυ ΨΓΘaΒγΦΪ…œΚ§ΝρΈΔΝΘΖ≈ΒγΒΡΖ¥”Π ΫΈΣ_________________________Θ®»Έ–¥“ΜΗωΘ©ΓΘάκΉ”ΫΜΜΜΡΛ______Θ®Χν±ξΚ≈Θ©ΈΣ“θάκΉ”ΫΜΜΜΡΛΓΘ

Θ®5Θ©2SO3(g)![]() 2SO2(g)+O2(g)Θ§ΫΪ“ΜΕ®ΝΩΒΡSO3Ζ≈»κΚψ»ίΒΡΟή±’»ίΤς÷–Θ§≤βΒΟΤδΤΫΚβΉΣΜ·¬ ΥφΈ¬Ε»±δΜ·»γΆΦΥυ ΨΓΘΆΦ÷–aΒψΕ‘”ΠΈ¬Ε»œ¬Θ§“―÷ΣSO3ΒΡΤπ Φ―Ι«ΩΈΣP0,ΗΟΈ¬Ε»œ¬Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐKp= _______Θ®”ΟΤΫΚβΖ÷―Ι¥ζΧφΤΫΚβ≈®Ε»ΦΤΥψΘ§Ζ÷―Ι=Ήή―ΙΓΝΈο÷ ΒΡΝΩΖ÷ ΐΘ©ΓΘ‘ΎΗΟΈ¬Ε»œ¬¥οΒΫΤΫΚβΘ§‘Όœρ»ίΤς÷–Φ”»κΒ»Έο÷ ΒΡΝΩSO2ΚΆSO3,ΤΫΚβΫΪ___________Θ®ΧνΓΑœρ’ΐΖ¥”ΠΖΫœρΓ±ΜρΓΑœρΡφΖ¥”ΠΖΫœρΓ± ΓΑ≤ΜΓ±Θ© “ΤΕ·ΓΘ
2SO2(g)+O2(g)Θ§ΫΪ“ΜΕ®ΝΩΒΡSO3Ζ≈»κΚψ»ίΒΡΟή±’»ίΤς÷–Θ§≤βΒΟΤδΤΫΚβΉΣΜ·¬ ΥφΈ¬Ε»±δΜ·»γΆΦΥυ ΨΓΘΆΦ÷–aΒψΕ‘”ΠΈ¬Ε»œ¬Θ§“―÷ΣSO3ΒΡΤπ Φ―Ι«ΩΈΣP0,ΗΟΈ¬Ε»œ¬Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐKp= _______Θ®”ΟΤΫΚβΖ÷―Ι¥ζΧφΤΫΚβ≈®Ε»ΦΤΥψΘ§Ζ÷―Ι=Ήή―ΙΓΝΈο÷ ΒΡΝΩΖ÷ ΐΘ©ΓΘ‘ΎΗΟΈ¬Ε»œ¬¥οΒΫΤΫΚβΘ§‘Όœρ»ίΤς÷–Φ”»κΒ»Έο÷ ΒΡΝΩSO2ΚΆSO3,ΤΫΚβΫΪ___________Θ®ΧνΓΑœρ’ΐΖ¥”ΠΖΫœρΓ±ΜρΓΑœρΡφΖ¥”ΠΖΫœρΓ± ΓΑ≤ΜΓ±Θ© “ΤΕ·ΓΘ

≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Υα–‘ΙΛ“ΒΖœΥ°÷–Κ§”–K2Cr2O7ΓΘΙβ’’œ¬Θ§≤ίΥαΘ®H2C2O4Θ©ΡήΫΪΤδ÷–ΒΡCr2O72-ΉΣΜ·ΈΣCr3+ΓΘΡ≥ΩΈΧβΉι―–ΨΩΖΔœ÷Θ§…ΌΝΩΧζΟςΖ·[Al2Fe(SO4)4ΓΛ24H2O]Φ¥Ω…Ε‘ΗΟΖ¥”ΠΕ―Τπ¥ΏΜ·Ής”ΟΓΘΈΣΫχ“Μ≤Ϋ―–ΨΩ”–ΙΊ“ρΥΊΕ‘ΗΟΖ¥”ΠΥΌ¬ ΒΡ”ΑœλΘ§ΧΫΨΩ»γœ¬ΘΚ
Θ®1Θ©‘Ύ25ΓψCœ¬Θ§ΩΊ÷ΤΙβ’’«ΩΕ»ΓΔΖœΥ°―υΤΖ≥θ Φ≈®Ε»ΚΆ¥ΏΜ·ΦΝ”ΟΝΩœύΆ§Θ§ΒςΫΎ≤ΜΆ§ΒΡ≥θ ΦpHΚΆ“ΜΕ®≈®Ε»≤ίΥα»ή“Κ”ΟΝΩΘ§ΉωΕ‘±» Β―ιΓΘ«κΆξ≥…“‘œ¬ Β―ι…ηΦΤ±μΘ®±μ÷–≤Μ“ΣΝτΩ’ΗώΘ©ΓΘ
Β―ι–ρΚ≈ | ≥θ ΦpH | ΖœΥ°―υΤΖΧεΜΐ/mL | ≤ίΥα»ή“ΚΧεΜΐ/mL | ’τΝσΥ°ΧεΜΐ/mL |
ΔΌ | 4.0 | 60.0 | 10.0 | 30.0 |
ΔΎ | 5.0 | 60.0 | 10.0 | 30.0 |
Δέ | 5.0 | 60.0 | ______ | ______ |
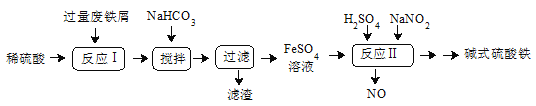
≤βΒΟ Β―ιΔΌΚΆΔΎ»ή“Κ÷–Cr2O72-ΒΡ≈®Ε»Υφ ±Φδ±δΜ·ΙΊœΒ»γΆΦΥυ ΨΓΘ
Θ®2Θ©…œ ωΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_______ΓΘ
Θ®3Θ©Ε‘±» Β―ιΔΌΚΆΔΎΒΡΫαΙϊΩ…ΒΟ≥ωΫα¬έ______ΓΘ Β―ιΔΌ÷–0ΓΪt1 ±ΦδΕΈΖ¥”ΠΥΌ¬ v(Cr3+)=_____(”Ο¥ζ ΐ Ϋ±μ Ψ)ΓΘ
Θ®4Θ©ΗΟΩΈΧβΉιΕ‘ΧζΟςΖ·[Al2Fe(SO4)4ΓΛ24H2O]÷–Τπ¥ΏΜ·Ής”ΟΒΡ≥…Ζ÷Χα≥ω»γΝΥœ¬ΦΌ…ηΘ§«κΡψΆξ≥…ΦΌ…ηΕΰΘΚ
ΦΌ…η“ΜΘΚFe2+Τπ¥ΏΜ·Ής”ΟΘΜ
ΦΌ…ηΕΰΘΚ___________ΘΜ
ΓΛΓΛΓΛΓΛΓΛΓΛ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫ”¥ΞΖ®÷ΤΝρΥαΙΛ“’÷–Θ§Τδ÷ςΖ¥”Π»γœ¬ΘΚ
2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g) ![]() H=Θ≠197 kJ/mol
H=Θ≠197 kJ/mol
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. “ρΈΣΖ¥”ΠΖ≈»»Θ§Υυ“‘ΗΟΖ¥”Π≤Μ–η“ΣΦ”»»Φ¥ΡήΩλΥΌΖ¥”Π
B. ‘ω¥σO2ΒΡ≈®Ε»Ω…“‘ΧαΗΏΖ¥”ΠΥΌ¬ ΚΆSO2ΒΡΉΣΜ·¬
C. Ζ¥”Π450Γφ ±ΒΡΤΫΚβ≥Θ ΐ–Γ”Ύ500Γφ ±ΒΡΤΫΚβ≥Θ ΐ
D. ΚψΈ¬œ¬Υθ–Γ»ίΤς»ίΜΐΘ§ ΙQ > K
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗ¥Β©¥σ―ß―–ΖΔΒΡ“Μ÷÷–¬–ΆΥ°ο°Βγ≥ΊΘ§“ΜΦΪ≤…”ΟΗ¥ΚœΡΛΑϋΙϋΒΡΫπ το°Θ§Νμ“ΜΦΪ≤…”ΟΟΧΥαο°(LiMn2O4)Θ§“‘0.5molΓΛL-1Li2SO4Υ°»ή“ΚΉςΒγΫβ÷ Θ§Α≤»Ϊ–‘ΡήΚΆ≥…±ΨΫœœ÷”–ΒΡο°άκΉ”Βγ≥ΊΕΦΨΏ”–Οςœ‘ΒΡ”≈ ΤΓΘœ¬Ν–”–ΙΊΗΟΒγ≥ΊΒΡΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©

A.ΒγΦΪa «ΗΚΦΪΘ§ΒγΦΪb «’ΐΦΪ
B.ΙΛΉς ±Βγ≥ΊΒΡΉήΖ¥”ΠΈΣΘΚLiMn2O4+Li=Li2Mn2O4
C.Ζ≈Βγ ±Θ§»ή“Κ÷–Li+¥”aœρb«®“Τ
D.Βγ≥ΊΖ≈Βγ ±ΒΡ―τΦΪΖ¥”Π ΫΈΣΘΚLi2Mn2O4e-=LiMn2O4+Li+
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΒγΫβ÷ ΒΡΥ°»ή“Κ÷–¥φ‘ΎΒγάκΤΫΚβΓΘ
Θ®1Θ©¥ΉΥα «≥ΘΦϊΒΡ»θΥαΓΘ
ΔΌ¥ΉΥα‘ΎΥ°»ή“Κ÷–ΒΡΒγάκΖΫ≥Χ ΫΈΣ____________ΓΘ
ΔΎœ¬Ν–ΖΫΖ®÷–Θ§Ω…“‘ Ι¥ΉΥα»ή“Κ÷–CH3COOHΒγάκ≥ΧΕ»‘ω¥σΒΡ «_______Θ®ΧνΉ÷ΡΗ–ρΚ≈Θ©ΓΘ
a ΒΈΦ”…ΌΝΩ≈®―ΈΥα b ΈΔ»»»ή“Κ c Φ”Υ°œΓ Ά d Φ”»κ…ΌΝΩ¥ΉΥαΡΤΨßΧε
Θ®2Θ©œ¬±μΈΣΡ≥Ά§―ßΥυ≤β25Γφ ±Θ§ΦΉΓΔ““ΝΫ÷÷»ή“ΚΒΡpHΓΘ
ΦΉ | ““ | |
pH | 11 | 11 |
»ή“Κ | Α±Υ° | «β―θΜ·ΡΤ»ή“Κ |
ΔΌΦΉ»ή“Κ÷–ΒΡc(OH-) =___________mol/LΓΘ
ΔΎ25Γφ ±Θ§Β»ΧεΜΐΒΡΦΉΓΔ““ΝΫ»ή“Κ”κΒ»≈®Ε»ΒΡ―ΈΥαΖ¥”ΠΘ§œϊΚΡΒΡ―ΈΥαΧεΜΐΘΚΦΉ_____““ΓΘ
ΔέΦΉΓΔ““»ή“ΚΨυΦ”Υ°œΓ Ά10±ΕΚσΘ§ΥυΒΟ»ή“ΚΒΡpHΘΚΦΉ_____““ΓΘ
Θ®3Θ©“―÷ΣΕύ‘Σ»θΥα‘ΎΥ°»ή“Κ÷–ΒΡΒγάκ «Ζ÷≤ΫΫχ––ΒΡΘ§«“ΒΎ“Μ≤ΫΒΡΒγάκ≥ΧΕ»¥σ”ΎΒΎΕΰ≤ΫΒΡΒγάκ≥ΧΕ»Θ§ΒΎΕΰ≤ΫΒΡΒγάκ≥ΧΕ»‘Ε¥σ”ΎΒΎ»ΐ≤ΫΒΡΒγάκ≥ΧΕ»Γ≠Γ≠Ϋώ”–HAΓΔH2BΓΔH3C»ΐ÷÷»θΥαΘ§ΗυΨίΓΑΫœ«ΩΥα + Ϋœ»θΥα―Έ = Ϋœ«ΩΥα―Έ + Ϋœ»θΥαΓ±ΒΡΖ¥”ΠΙφ¬…Θ§ΥϋΟ«÷°ΦδΡήΖΔ…ζœ¬Ν–Ζ¥”ΠΘΚ
a.HA + HC2-(…ΌΝΩ) = A-+ H2C-
b.H2B(…ΌΝΩ) + 2A- = B2- + 2HA
c.H2B(…ΌΝΩ) + H2C- = HB-+ H3C
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
ΔΌœύΆ§ΧθΦΰœ¬Θ§HAΓΔH2BΓΔH3C»ΐ÷÷Υα÷–Θ§Υα–‘Ήν«ΩΒΡ «_____________ΓΘ
ΔΎœ¬Ν–Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ’ΐ»ΖΒΡ «____________ΓΘ
A.H3C +3A- = 3HA + C3- B.HB- +A- = HA + B2-
ΔέΆξ≥…œ¬Ν–Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ
a.H3C + OH-(ΙΐΝΩ)ΓΣΓΣ__________________ΘΜb.HA(ΙΐΝΩ) + C3- ΓΣΓΣ_____________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ![]() ΚΆ
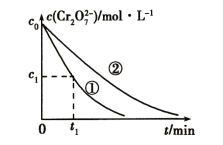
ΚΆ![]() ¥ΏΜ·÷Ί’ϊΩ…÷Τ±ΗΚœ≥…ΤχΘ§Ε‘ΦθΜΚ»ΦΝœΈΘΜζΨΏ”–÷Ί“ΣΒΡ“β“εΘ§ΤδΖ¥”Πάζ≥Χ Ψ“βΆΦ»γΆΦ(ΆΦ÷–«ρΙςΡΘ–Ά÷–ΒΡΓΑΙςΓ±Ω…±μ ΨΒΞΦϋΓΔΥΪΦϋΜρ»ΰΦϋ)Θ§“―÷ΣΘΚ
¥ΏΜ·÷Ί’ϊΩ…÷Τ±ΗΚœ≥…ΤχΘ§Ε‘ΦθΜΚ»ΦΝœΈΘΜζΨΏ”–÷Ί“ΣΒΡ“β“εΘ§ΤδΖ¥”Πάζ≥Χ Ψ“βΆΦ»γΆΦ(ΆΦ÷–«ρΙςΡΘ–Ά÷–ΒΡΓΑΙςΓ±Ω…±μ ΨΒΞΦϋΓΔΥΪΦϋΜρ»ΰΦϋ)Θ§“―÷ΣΘΚ![]() Θ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «( )
Θ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «( )
A.Ζ¥”ΠΔΌΈΣΈϋ»»Ζ¥”ΠΘ§«“![]()
B.¥ΏΜ·ΦΝ![]() Ε‘Ζ¥”ΠΔΌΚΆΖ¥”ΠΔΎΕΦ”–¥ΏΜ·Ής”Ο
Ε‘Ζ¥”ΠΔΌΚΆΖ¥”ΠΔΎΕΦ”–¥ΏΜ·Ής”Ο
C.Ζ¥”ΠΔΎΙΐ≥Χ÷–Φ»”–ΧΦ―θΦϋΒΡΕœΝ―Θ§“≤”–ΧΦ―θΦϋΒΡ–Έ≥…
D.Ζ¥”ΠΔΎΒΡΜνΜ·ΡήΈΣ![]() Θ§Ζ¥”Πλ ±δ
Θ§Ζ¥”Πλ ±δ![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΕΧ÷ήΤΎ÷ςΉε‘ΣΥΊWΓΔXΓΔYΓΔZΒΡ‘≠Ή”–ρ ΐ÷πΫΞ‘ω¥σΘ§ΥΡ÷÷‘ΣΥΊ–Έ≥…ΒΡΜ·ΚœΈοΦΉΒΡΫαΙΙ»γΆΦΥυ ΨΓΘ«“W”κXΓΔYΓΔZΨυΩ…–Έ≥…ΒγΉ” ΐœύΒ»ΒΡΖ÷Ή”Θ§![]() ≥ΘΈ¬≥Θ―Ιœ¬ΈΣ“ΚΧεΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
≥ΘΈ¬≥Θ―Ιœ¬ΈΣ“ΚΧεΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
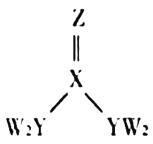
A.XΓΔYΒΡΦρΒΞ«βΜ·ΈοΒΡΈ»Ε®–‘ΘΚ![]()
B.WΓΔYΓΔZ»ΐ÷÷‘ΣΥΊ≤ΜΡή–Έ≥…άκΉ”Μ·ΚœΈο
C.![]() ΦΉΖ÷Ή”÷–¥φ‘Ύ
ΦΉΖ÷Ή”÷–¥φ‘Ύ![]() Φϋ
Φϋ
D.Y‘ΣΥΊΒΡΦρΒΞ«βΜ·ΈοΡή Ι Σ»σΒΡΚλ…Ϊ ·»ο ‘÷Ϋ±δάΕ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com