
【题目】写出下列反应的热化学方程式:
(1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1 366.8 kJ热量: 。
(2)1 mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量: 。
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量: 。
⑷已知下列反应的反应热为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ/mol
试计算下述反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______________
【答案】(1)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ/mol
(2)C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol
(3)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-906.80kJ/mol
(4)-488.3kJ/mol
【解析】
试题分析:(1)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8KJ热量,标注物质的聚集状态和对应反应焓变写出热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol。
(2)1mol碳(石墨)与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3kJ热量,热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol。
(3)1.7g氨气即0.1molNH3(g)发生催化氧化反应生成气态产物,放出22.67kJ的热量,所以4molNH3(g)发生催化氧化反应生成气态产物,放出22.67kJ×40=906.80kJ的热量,热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906.80kJ/mol。
(4)已知①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
③H2(g)+![]() O2(g)=H2O(l)△H3=-285.8kJ/mol
O2(g)=H2O(l)△H3=-285.8kJ/mol
根据盖斯定律,△H=△H2×2+△H3×2—△H1=-488.3kJ/mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(6分)在2 L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡(X、Y、Z均为气态)。

(1)该反应的化学方程式是 。
(2)反应起始至t时刻,Y的平均反应速率是 。
(3)关于该反应的说法正确的是 。
A.到达t时刻该反应已停止 |
B.在t时刻之前X的消耗速率大于它的生成速率 |
C.在t时刻正反应速率等于逆反应速率 |
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比为1:1或2:1形成化合物;CB可与EA2反应生成C2A与气态物质EB4;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:B_________,E_____________。
(2)写出电子式:EB4__________。
(3)D2A2中含有的化学键为___________________________。
(4)由A、C、D三种元素组成的化合物M属于____(填“离子”或“共价”)化合物;M溶于水后______(填“是”或“否”)发生化学变化,原因是______________________(从化学键角度分析)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品:
仪器:试管、胶头滴管
药品:氯水、溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容):
序号 | 实验方案 | 实验现象 |
① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈__色 |
② | 向盛有少量碘化钾溶液的试管中滴加少量新制溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈__色 |
(4)实验结论:____________________。
(5)问题和讨论:
①上述两个实验中发生的反应的离子方程式分别为_________、________。
②由于氟过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯强:_______、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各数值表示有关元素的原子序数,其表示的各原子之间能以离子键形成稳定化合物的是( )。
A.10和19 B.6和16
C.14和8 D.11和17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 在稀溶液中,1 mol酸和1 mol碱完全反应所放出的热量,叫做中和热
B. 在101 kPa时,1 mol物质燃烧时所放出的热量叫做该物质的燃烧热
C. 热化学方程式中,各物质前的化学计量数不表示分子个数
D. 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为铜锌原电池的装置图,根据装置图填写空白.
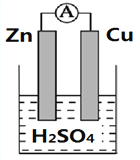
(1)将________转化为________的装置叫做原电池
(2)Zn极上的电极反应式为:_____________________________________。
(3)Cu极发生的是_____________反应(“氧化”或“还原”)。铜片上观察到的现象为___________________;
(4)溶液中H+的流动方向为__________________;
(5)若烧杯中溶液为AgNO3溶液,则负极为________(填Zn或Cu),总反应方程式为________________________________。
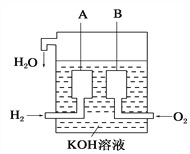
(6)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。该电池的正极反应物为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量的浓度和混合液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸? 。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
Ⅱ.某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:

⑴ 该反应的化学方程式为:_________________________
⑵ 反应开始至2min,用Z表示的平均反应速率为:_____________
⑶ 下列叙述能说明上述反应达到化学平衡状态的是_____(填序号)
A.混合气体的总压强不随时间的变化而变化
B.混合气体的平均摩尔质量不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com