
����Ŀ���������ڶ����������ܣ���;ʮ�ֹ㷺���н�����ά������֮�ơ����������գ�
��1�����Ϸ�����(��Ҫ�ɷ� V2O5)��ϡ���ᡢ���������Һ��ϣ���ַ�Ӧ��������Һ�����ԣ���Һ�к� VO2����K����SO42�������ӡ�д���÷�Ӧ�Ļ�ѧ����ʽ��____________��
��2��������������Һ�м��� KClO3 ��Һ����ַ�Ӧ����Һ���������� VO2����Cl����д������ƽ�÷�Ӧ�����ӷ���ʽ�����������ת�Ƶ���Ŀ�ͷ���_____��
��3����֪V2O5 �ܺ����ᷴӦ����������VO2��������дһ�����ӷ���ʽ��________��˵����ԭ�ԣ�SO32��>Cl��>VO2����
���𰸡�V2O5��K2SO3��2H2SO4===2VOSO4��K2SO4��2H2O ![]() ��3H2O===Cl����6VO2����6H�� Cl2��SO32����H2O===2Cl����2H����SO42��
��3H2O===Cl����6VO2����6H�� Cl2��SO32����H2O===2Cl����2H����SO42��
��������
��1���������֪��V2O5��ϡ���ᡢ������ط�Ӧ����VOSO4��K2SO4����Ԫ���غ��֪������H2O��
��2��ClO3����VO2����Ӧ����VO2����Cl�������ݵ���غ㡢ԭ���غ�ȷ���������ʲ���ƽ��
��3��V2O5�ܺ����ᷴӦ����������VO2�����ʻ�ԭ��Cl����VO2�����������Խ�������������������������������ԭΪCl��������˵����ԭ��SO32����Cl����
��1���������֪��V2O5��ϡ���ᡢ������ط�Ӧ����VOSO4��K2SO4����Ԫ���غ��֪������H2O����ƽ��ʽΪ��V2O5+K2SO3+2H2SO4=2VOSO4+K2SO4+2H2O��
��2��ClO3����VO2����Ӧ����VO2����Cl������Ԫ�ػ��ϼ���+5����Ϊ-1��������6�ۣ�VԪ�ػ��ϼ���+4����Ϊ+5��������1�ۣ����ϼ�������С������Ϊ6����ClO3����ϵ��Ϊ1��VO2��ϵ��Ϊ6����ԭ���غ��֪��VO2����ϵ��Ϊ6��Cl����ϵ��Ϊ1���ɵ���غ��֪������H����ϵ��Ϊ6������ˮ�μӷ�Ӧ��ϵ��Ϊ3����ƽ�÷�Ӧ�����ӷ���ʽ�����������ת�Ƶ���Ŀ�ͷ���Ϊ��![]() ��3H2O===Cl����6VO2����6H�� ��
��3H2O===Cl����6VO2����6H�� ��
��3��V2O5�ܺ����ᷴӦ����������VO2�����ʻ�ԭ��Cl����VO2�����������Խ�������������������������������ԭΪCl��������˵����ԭ��SO32����Cl������Ӧ���ӷ���ʽΪ��Cl2+SO32��+H2O=2Cl��+2H��+SO42����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�ã�������������ȷ���ǣ� ��
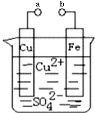
A. a��b������ʱ����Ƭ�ϻ��н���ͭ����
B. a��b�õ�������ʱ����Ƭ�Ϸ����ķ�ӦΪ��Fe��2e��=Fe2��
C. a��b�õ�������ʱ���Ӵ�CuƬ������Ƭ
D. a��b�õ�������ʱ��Cu2����ͭ�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к�H����SO42����NO3-�������ӣ�����H����SO42�������ʵ���Ũ�ȷֱ�Ϊ7.0 mol��L��1��2.0 mol��L��1��ȡ����Һ20 mL������3.2 gͭ�ۣ�����ʹ���dz�ַ�Ӧ�������������ڱ�״���µ����ԼΪ( )
A. 0.75 LB. 0.336 LC. 1.5 LD. 0.448 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
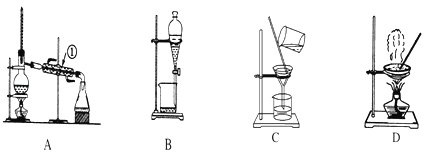
����Ŀ����ͼ�Ƿ�������ʱ���õ����������Խ��еĻ�����������ֱ��ǣ���
![]()
A.�����ˡ���ȡ������B.������������ȡ������
C.��ȡ�����ˡ���������D.���ˡ���������ȡ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2Fe2++Cl2===2Cl��+2Fe3+��2Br��+Cl2===Br2+2Cl����2Fe2++Br2===2Br��+2Fe3+������amol FeBr2����Һ�У�ͨ��xmol Cl2�����и���ΪͨCl2�����У���Һ�ڷ�����Ӧ�����ӷ���ʽ�����в���ȷ���ǣ�������
A. x=0.4a��2Fe2++Cl2===2Fe3++2Cl��
B. x=0.6a��2Br��+Cl2===Br2+2Cl��
C. x=a��2Fe2++2Br��+2Cl2===Br2+2Fe3++4Cl��
D. x=1.5a��2Fe2++4Br��+3Cl2===2Br2+2Fe3++6Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����������װ��̽�������백���ķ�Ӧ������A��B�ֱ�Ϊ�����Ͱ����ķ���װ�ã�CΪ��������������백����Ӧ��װ�ã�
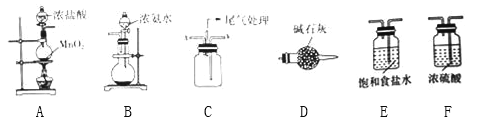
��1����Cl2��������������NH3��������������������ʵ��װ���У��������ӵĺ���˳��Ϊ��A��________________��B��ΪʹNH3��Cl2����ֻ�ϣ�Cl2Ӧ��Cװ�õ�__�ڽ��루�x����y������
��2������װ��A��ʹ�÷�Һ©����Բ����ƿ�еμ�Ũ����IJ�����__________________��
��3��װ��A�з�����Ӧ�����ӷ���ʽΪ_______________________________��
��4��װ��B��Բ����ƿ�ڵ��Լ�Ϊ______________�������ƣ���
��5��װ��D��������____________________________��
��6����Ӧ��ʼ��װ��C�ڳ���Ũ��İ��̲��������ڱ����ᣬ��һ�������ǿ����е���Ҫ�ɷ�֮һ���÷�Ӧ�Ļ�ѧ����ʽΪ________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ��
ij��ѧ��ȤС����������װ�ã�������ʵ�鷽������ȡ����(1)(2)(3)(4)���IJ������Ӻ���������ȡ���п��������Ե���Ȼ���(��֪�ױ��ͼ״���Ϊ�л��ܼ����л������ܻ���)
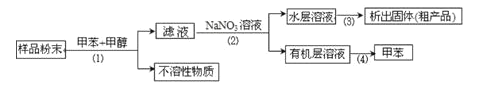
(1)װ��A�������ٵ�������________��ʹ��װ��A������������Ӧ����________(��������(1)��������(2)��������(3)������(4)������ͬ)��
(2)ʹ��װ��B������������Ӧ����________�ڸò����У�������ʱ��Ϊ�˱�����Һ��ӷ��������ڲ���ѹ����Ӧ���еIJ�����________(��д����IJ�������)��
(3)ʹ��װ��C������������Ӧ����________�������ó���������ˮ����Ҫϴ�ӣ���ϴ�ӵľ��������________��
(4)ʹ��װ��D������������Ӧ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ����һ�������������仯�������������������й㷺��;��
��1����ԭ����Χ���ӹ����ʾʽΪ____________________����ԭ�Ӻ�����ӷ���ԾǨʱ�����ջ��ͷŲ�ͬ�Ĺ⣬������_________��ȡ��Ԫ�ص�ԭ�ӹ��ס�
��2��FeCoOx��һ���������������ĵ����ܴ�С��ϵ��I4(Co)____I4(Fe)������>������<�� ) ��ԭ����_____________��
��3����ï��[(C5H5)2Fe]���������ȼ�����Ӽ������Ϳ���������ï���۵�172�棬�е�249 �棬��������������ˮ���������л��ܼ���������_____________���塣
��4�������ϩ��C5H6���ṹ��ͼ��a�����������ƶ�ï���������ϩ��̼ԭ�ӵ��ӻ���ʽΪ________�������еĴ��������÷���![]() ��ʾ����m���������γɴ�������ԭ������n���������γɴ������ĵ������������ϩ�����ӣ�C5H5�D���ṹ��ͼ(b)�����еĴ��������Ա�ʾΪ_________________��
��ʾ����m���������γɴ�������ԭ������n���������γɴ������ĵ������������ϩ�����ӣ�C5H5�D���ṹ��ͼ(b)�����еĴ��������Ա�ʾΪ_________________��
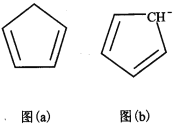
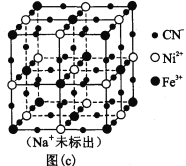
��5��ij��³ʿ������������Ϊ���������ӵ�ص缫���ϡ�����Na+��Ni2+��Fe3+��CN�D���ɣ��侧���ṹ��ͼ(c)���������У�������________�����ţ���A�����Ӽ� B�� ���� C�� ���� D�� ��� E�� ������
��6���þ�����Fe3+���õĶѻ���ʽ��_______��ѡ��Po��Na��Mg��Cu����ͬ��������������λ��϶�й�����_____�� Na+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йذ�����ε�˵������ȷ����
A. ����ʪ��ĺ�ɫʯ����ֽ���鰱��
B. ������ζ���ˮ������Һ������ʱ��c(NH4+) = c(Cl)
C. NH3�����������
D. ����ʱ��0.1 mol��L1NH4Cl��Һ��ˮϡ�ͣ�![]() ��ֵ����
��ֵ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com