
【题目】铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子外围电子轨道表示式为____________________,铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用_________摄取铁元素的原子光谱。
(2)FeCoOx是一种新型光电催化剂。第四电离能大小关系是I4(Co)____I4(Fe)(填“>”或“<” ) ,原因是_____________。
(3)二茂铁[(C5H5)2Fe]可用作火箭燃料添加剂、汽油抗爆剂。二茂铁熔点172℃,沸点249 ℃,易升华,难溶于水,易溶于有机溶剂,它属于_____________晶体。
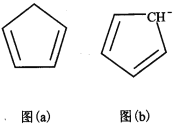
(4)环戊二烯(C5H6)结构如图(a),可用于制二茂铁。环戊二烯中碳原子的杂化方式为________。分子中的大π键可用符号![]() 表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H5―)结构如图(b),其中的大π键可以表示为_________________。
表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H5―)结构如图(b),其中的大π键可以表示为_________________。
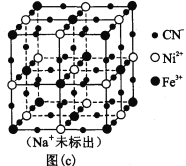
(5)某普鲁士蓝类配合物可作为新型钠离子电池电极材料。它由Na+、Ni2+、Fe3+和CN―构成,其晶胞结构如图(c)。该物质中,不存在________(填标号)。A.离子键 B. σ键 C. π键 D. 氢键 E. 金属键
(6)该晶胞中Fe3+采用的堆积方式与_______(选填Po、Na、Mg、Cu)相同,单个晶胞的配位空隙中共容纳_____个 Na+。
【答案】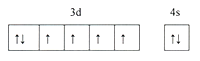 光谱仪 < 铁失去的是处于半充满状态的3d5的一个电子,相对较难;钴失去3d6上的一个电子后形成稳定的半充满状态,相对容易 分子 sp2 sp3
光谱仪 < 铁失去的是处于半充满状态的3d5的一个电子,相对较难;钴失去3d6上的一个电子后形成稳定的半充满状态,相对容易 分子 sp2 sp3 ![]() DE Cu 4
DE Cu 4
【解析】
(1)铁原子序数为26,由构造原理可知,铁原子核外电子排布式为1s22s22p63s23p63d6 4s2,外围电子排布式为3d64s2,据此写出轨道表示式;
核外电子发生跃迁时会吸收或释放不同的光,形成光谱,可以用光谱仪获取原子光谱;
(2)Co原子序数为27,Co3+核外电子排布式为1s22s22p63s23p63d6、Fe3+核外电子排布式为1s22s22p63s23p63d5,为半充满的稳定状态,失去电子较难,需要较高能量,据此分析解答;
(3)根据该晶体的物理性质分析判断晶体类型;
(4)根据环戊二烯(C5H6)的结构式、结合C原子四键规律分析C原子的杂化类型;由环戊二烯负离子(C5H5-)结构图可知,环戊二烯负离子,由两个双键和一个负电荷组成环状共轭体系,π电子数是6,即六个π电子,据此写出大π键符号;
(5)分析构成普鲁士蓝类配合物的粒子可知,该物质是离子化合物,含有CN-,CN-中存在C≡N三键;
(6)抽出晶胞中Fe3+和CN-可知,晶胞中Ni2+位于体心和棱心位置,配位数是12,晶胞中含有Ni2+数目为12×![]() +1=4,是面心立方最密堆积,类似于Cu晶胞;晶胞中Fe3+的数目为8×
+1=4,是面心立方最密堆积,类似于Cu晶胞;晶胞中Fe3+的数目为8×![]() +6×
+6×![]() =4,CN-的数目为24×
=4,CN-的数目为24×![]() +24×
+24×![]() +6=24,结合化合物中阴阳离子电荷数相等推断Na+的数目。
+6=24,结合化合物中阴阳离子电荷数相等推断Na+的数目。
铁原子序数为26,核外电子排布式为1s22s22p63s23p63d6 4s2,外围电子排布式3d6 4s2,外围电子轨道排布式为 ;核外电子发生跃迁时会吸收或释放不同的光,形成光谱,可以用光谱仪获取原子光谱,
;核外电子发生跃迁时会吸收或释放不同的光,形成光谱,可以用光谱仪获取原子光谱,
故答案为: ;光谱仪;
;光谱仪;
(2)Co3+核外电子排布式为1s22s22p63s23p63d6,不是特殊结构,失去一个电子形成1s22s22p63s23p63d5结构需要能量不大,Fe3+核外电子排布式为1s22s22p63s23p63d5,是半充满的稳定结构,再失去一个电子形成不稳定结构需要较高能量,所以I4(Co)<I4(Fe),
故答案为:<;铁离子失去处于半充满3d5的一个电子,相对困难,钴离子失去3d6上的一个电子形成较稳定的半充满状态,相对容易;
(3)二茂铁晶体熔沸点不高、易升华、易溶于有机溶剂,符合分子晶体特征,所以该晶体为分子晶体,
故答案为:分子;
(4)由环戊二烯(C5H6)的结构式可知,环戊二烯中有4个C原子形成有C=C双键,1个C原子含有4个CH单键,即有两种C原子,所以杂化类型为sp2和sp3;由环戊二烯负离子(C5H5)结构图可知,环戊二烯负离子,由两个双键和一个负电荷组成环状共轭体系,π电子数是6,即形成5个碳原子、6个π电子的大π键,符号为![]() ,
,
故答案为:sp2、sp3;![]() ;
;
(5)普鲁士蓝类配合物由Na+、Ni2+、Fe3+和CN构成,是离子化合物,存在离子键,含有CN,CN中存在C≡N三键,一个C≡N由1个σ键和2个π键组成,化合物中不存在氢键和金属键,
故答案为:DE;
(6)抽出晶胞中Fe3+和CN可知,晶胞中Ni2+位于体心和棱心位置,配位数是12,晶胞中含有Ni2+数目为12×![]() +1=4,为面心立方最密堆积,类似于Cu晶胞;晶胞中Fe3+的数目为8×
+1=4,为面心立方最密堆积,类似于Cu晶胞;晶胞中Fe3+的数目为8×![]() +6×
+6×![]() =4,CN的数目为24×
=4,CN的数目为24×![]() +24×
+24×![]() +6=24,化学式为NaxNi4Fe4(CN)24,由于化合物中阴阳离子电荷数相等,x+4×2+4×3=24×1,解得x=4。即单个晶胞的配位空隙中共容纳Na+的数目为4,
+6=24,化学式为NaxNi4Fe4(CN)24,由于化合物中阴阳离子电荷数相等,x+4×2+4×3=24×1,解得x=4。即单个晶胞的配位空隙中共容纳Na+的数目为4,
故答案为:Cu;4。


科目:高中化学 来源: 题型:
【题目】利用太阳能分解水制氢,若光解0.02 mol水,下列说法正确的是
A.可生成H2的质量为0.02g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224 L(标准情况)
D.生成H2的量理论上等于0.48 g Mg与足量稀盐酸反应产生H2的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒具有众多优良的性能,用途十分广泛,有金属“维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分 V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性,溶液中含 VO2+、K+、SO42-等离子。写出该反应的化学方程式:____________。
(2)向上述所得溶液中加入 KClO3 溶液,充分反应后,溶液中新增加了 VO2+、Cl-。写出并配平该反应的离子方程式,并标出电子转移的数目和方向_____。
(3)已知V2O5 能和盐酸反应生成氯气和VO2+,请再写一个离子方程式:________,说明还原性:SO32->Cl->VO2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):
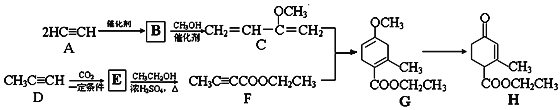
下列说法正确的是
A. B能和Br2的CCl4溶液发生加成反应,最多得到2种不同的有机产物
B. A发生加成反应生成B
C. 1 mol G完全燃烧生成7 mol H2O
D. H含有2种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中碳的质量分数为70.59%,氢的质量分数为 5.88%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构,A的质谱图、核磁共振氢谱、红外光谱图分别表示如下:
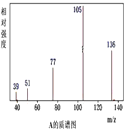
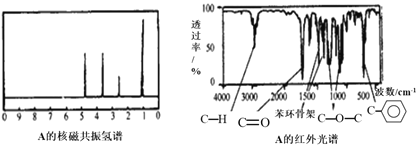
请回答下列问题:
(1)A的实验式为__________;
(2)A的结构简式为__________;
(3)该物质属于哪一类有机物____________;
(4)1molA在一定条件下可与___________molH2发生加成反应;
(5)A有多种同分异构体,同时满足下列条件的同分异构体M有______种。①属于芳香族化合物;②属于酯类;③分子结构中含有一个甲基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
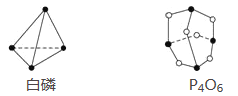
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一复盐,在造纸等方面应用广泛。某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如下:
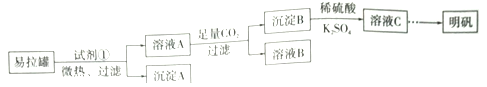
(1)试剂①应选用_____________(填代号)。
a.盐酸 b.H2SO4溶液 c.氯化钠溶液 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为____________________。
(3)溶液B中溶质的主要成分为____________________ (填化学式)。
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、__________(填操作名称)、过滤、洗涤、干燥。如下图所示,蒸发操作中的一处错误是_____________。

(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为_____________。(已知:明矾的摩尔质量为474g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)原子数相同,价电子数也相同的微粒,称为等电子体。等电子体具有相似的化学键特征,性质相似。CO的结构式为_______________。
(2)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式______ 。
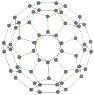
(3)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(![]() )的结构如图,分子中碳原子轨道的杂化类型为______;1 mol
)的结构如图,分子中碳原子轨道的杂化类型为______;1 mol ![]() 分子中
分子中![]() 键的数目为______ 。
键的数目为______ 。
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As_____Se(填“>”、“<”或“=”)。
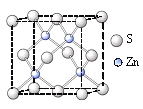
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是_______。
③二氧化硒分子的空间构型为________。
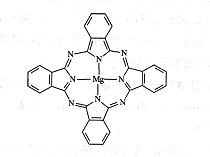
(5)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图,请在下图中用箭头表示出配位键。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.含有相同铜原子数的Cu2S和CuO的质量相等B.2g氢气所含质子数目为NA
C.lmol氨气含有的原子数目为2NAD.22.4LCH4所含电子数目为l0NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com