
【题目】ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。
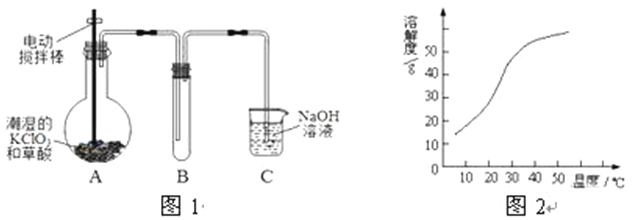
(1) A 装胃电动搅抖柞的作用是___________
(2)B装置必须放在冰水浴中,其原因是___________
(3)反应后在装置C中可得NaClO2溶液。已知I.NaClO2饱和溶液在温度低了38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2, 温度高于60℃时NaClO2分解生成NaClO3和NaCl;
Ⅱ.NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;②__________;③用38℃~60℃热水洗涤;④_____;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL(已知2 Na2S2O3+ I2=Na2S4O6+ 2NaI)。
①配制100 mLcmol·L-1Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:____________。
②原ClO2溶液的浓度为_________g/L(用含字母代数式表示)。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____________。(填“偏高”、“偏低”或“不变” )
【答案】 增大反应物的接触面积,加快反应速率 使ClO2充分冷凝,减少挥发 趁热过滤 低于60℃干燥 100mL容量瓶、胶头滴管 135cV2/V1 偏高
【解析】(1)A装置电动搅拌棒的作用是反应时搅拌,增大反应物的接触面积,加快反应速率;(2)B装置必须放在冰水浴中,其原因是使ClO2充分冷凝,减少挥发;(3)①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品。(4)①配制100 mL c mol/LNa2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有100 mL的容量瓶、胶头滴管;②设原ClO2溶液的物质的量浓度为x,根据反应2ClO2+10I-+8H+= 5I2+2Cl-+4H2O、2Na2S2O3+ I2=Na2S4O6+ 2NaI,则关系:
2ClO2~~~~~~~~~~~~~~5I2~~~~~~~~~~~~~~~10Na2S2O3
2 10
x×V1mL×10-3L/mL×![]() cmol·L-1×V2mL×10-3L/mL
cmol·L-1×V2mL×10-3L/mL
x=![]() mol/L,故原ClO2溶液的浓度为
mol/L,故原ClO2溶液的浓度为![]() g/L;③若滴定前滴定管尖嘴中有气泡,则滴定前读数偏小,而滴定后气泡消失,则消耗的标准溶液体积偏大,所以测定结果就偏高。
g/L;③若滴定前滴定管尖嘴中有气泡,则滴定前读数偏小,而滴定后气泡消失,则消耗的标准溶液体积偏大,所以测定结果就偏高。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 0.1mol/L氨水中,c(OH-)=c(NH4+)
B. 在常温下,10mL 0.02mol/L HCl溶液与10mL 0.02mol.LBa(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
C. 新制氯水中c(Cl-)=c(ClO-)+c(HClO)
D. 0.1mol/L KHC2O4溶液显酸性,溶液中c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,平衡常数如下:
2NO2![]() N2O4 K1 NO2
N2O4 K1 NO2![]() 1/2N2O4K2 N2O4
1/2N2O4K2 N2O4![]() 2NO2 K3
2NO2 K3
推导K1与K2,K1与K3的关系分别为:______________。
(2)衡量催化剂的性能指标有:活性、选择性、稳定性、价格等。对于给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂可以大幅度提高目标产物在最终产物中的____(填“产率”、“比率”、转化率),催化剂的这种特性,称作它的________性。
(3)溶液的pH对Cr2O72-降解率的影响如下图所示。
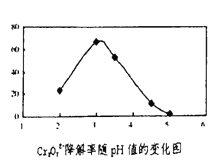
已知:Cu2O![]() Cu+CuSO4;
Cu+CuSO4;
酸性越大,Cr2O72-被还原率越大。
①由上右图可知,pH分别为2、3、4 时,Cr2O72-的降解率最好的是______,其原因是______。
②按右图加入10滴浓硫酸,溶液由橙黄色变为橙色,请结合化学用语用平衡移动原理解释其原因_____。
(4)一定条件下焦炭可以还原NO2,反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。在恒温的密闭容器下,6molNO2和足量C 发生该反应,测得平衡时NO2的物质的量与平衡总压的关系如图所示:
N2(g)+2CO2(g)。在恒温的密闭容器下,6molNO2和足量C 发生该反应,测得平衡时NO2的物质的量与平衡总压的关系如图所示:
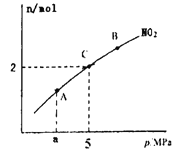
则C点NO2的转化率和C点时该反应的压强平衡常数Kp=(K,是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)分别为______、_______。
(5)已知由CO生成CO2的化学方程式为CO+O2![]() CO2+O。其正反应速率为v正=K正c(CO)·c(O2),逆反应速率为v逆=K逆c(CO2)·c(O),K正、K逆为速率常数。在2500K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_______(保留小数点后一位小数)。
CO2+O。其正反应速率为v正=K正c(CO)·c(O2),逆反应速率为v逆=K逆c(CO2)·c(O),K正、K逆为速率常数。在2500K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_______(保留小数点后一位小数)。
(6)利用水煤气合成二甲醚的三步反应如下:
①2H2(g) + CO(g) ![]() CH3OH(g); ΔH1
CH3OH(g); ΔH1
②CH3OH(g) ![]() CH2OCH3(g) + H2O(g); ΔH2
CH2OCH3(g) + H2O(g); ΔH2
③CO(g) + H2O(g) ![]() CO2(g) + H2(g); ΔH3
CO2(g) + H2(g); ΔH3
总反应: 3H2(g)+3CO(g) ![]() CH2OCH3(g)+CO2(g)的ΔH=_______。
CH2OCH3(g)+CO2(g)的ΔH=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 用过滤法除去食盐水中的少量泥沙
B. 用水溶解可除去氢氧化钠中的碳酸钠
C. 用蒸发结晶的方法从食盐水中提取氯化钠
D. 用加热法除去水中溶解的少量氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.纯碱和烧碱熔化时克服的化学键类型相同
B.碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力
C.SO3溶于水的过程中有共价键的断裂和离子键的形成
D.HF的热稳定性很好,主要是因为HF分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.1mol/L盐酸与50mL 0.2mol/L 氨水混合,在所得溶液中( )
A. c(Cl-)>c(NH4+)> c(OH-)> c(H+) B. c(Cl-)=c(NH4+)> c(OH-)= c(H+)
C. c(H+)+c(Cl-)=c(NH4+)+ c(OH-)+2c(NH3.H2O) D. c(H+)+ c(NH4+)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、CH4是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量分别为393.5kJ、890.3kJ.计算说明:(写出必要的文字说明和重要演算步骤,只写出最后答案的不能得分.有数值计算的题,数值结果保留到小数点后1位.)
(1)1g C完全燃烧时放出的热量.
(2)完全燃烧相同质量的C和CH4 , 哪种燃料放出热量较多?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属材料的说法不正确的是( )
A. 铁有良好的导热性,常用来制作炊具
B. 铜的化学性质不活泼,因此可用于制导线
C. 废旧电池中汞的回收可减少对环境的污染
D. 钛合金与人体有很好的相容性,因此可用来制造人造骨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com