
【题目】I.铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作___________剂。
(2)自然界的Cr主要以+3价和+6价(Cr2O72-)存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为Cr3+。写出该离子方程式:_________________________________。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是____________________________________。
II.(NH4)2Fe(SO4)2·6H2O(莫尔盐,浅绿色)用作化学试剂、医药以及用于冶金、电镀等。某课题组通过实验检验莫尔盐晶体加热时的分解产物,回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_________________________。
(2)①甲同学提出猜想:分解产物可能是N2、Fe2O3、SO3、H2O四种物质。你是否同意并说明理由:_________________________________________。
②乙同学设计了如图装置,其中装置中的固体变为红棕色,则固体产物中含有___________;
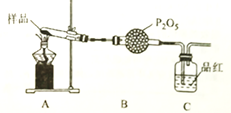
C装置中红色褪去,说明气体产物中含有_______;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是__________________(写一种即可)。
③丙同学想利用上述装罝证明分解产物中含有氨气,只需要更换B和C中的试剂即可,则更换后的试剂为B________________,C_______________。
【答案】 氧化 Cr2O72-+3SO32-+4H2O=2Cr3++3SO42-+8OH- 4Na+TiCl4 ![]() 4NaCl+Ti KSCN溶液 不同意。根据氧化还原反应规律,反应过程中有元素化合价升高必有元素化合价降低,而由产物可知,只有元素化合价升高而没有降低 Fe2O3 SO2 NaOH溶液 碱石灰 紫色石蕊试液
4NaCl+Ti KSCN溶液 不同意。根据氧化还原反应规律,反应过程中有元素化合价升高必有元素化合价降低,而由产物可知,只有元素化合价升高而没有降低 Fe2O3 SO2 NaOH溶液 碱石灰 紫色石蕊试液
【解析】I. (1)Ce的化合价由CeO2中的+4价降低到Ce3+中的+3价,所以CeO2在该反应中作氧化剂。
(2)Cr2O72-被SO32-还原为Cr3+,SO32-被氧化为SO42-,再根据得失电子守恒和质量守恒配平。先用得失电子守恒配平还原剂、氧化剂、氧化产物及还原产物,然后利用电荷守恒配平时发现反应物中带负电,生成物中不带电,所以在生成物中添加OH-,则在反应物中添加H2O再利用质量守恒配平其他粒子,其离子方程式为:Cr2O72-+3SO32-+4H2O=2Cr3++3SO42-+8OH-
(3)Na的还原性大于Ti,所以Na可以制取Ti,化学方程式为:4Na+TiCl4![]() 4NaCl+Ti
4NaCl+Ti
II. (1) (NH4)2Fe(SO4)2·6H2O中的Fe2+易被氧化为Fe3+,故检验莫尔盐是否变质可以用KSCN溶液来判断,若溶液显红色,说明已变质,如无明显的现象,说明未变质。答案为KSCN溶液。
(2)①从反应物(NH4)2Fe(SO4)2·6H2O到生成物N2、Fe2O3、SO3、H2O,N元素的化合价升高、Fe元素的化合价升高,没有化合价降低的元素,不符合氧化还原反应规律,故不同意这个猜想。答案为:不同意、根据氧化还原反应规律,反应过程中有元素化合价升高必有元素化合价降低,而由产物可知,只有元素化合价升高而没有降低。
② 固体变为红棕色,根据元素守恒可知,该固体为Fe2O3;品红褪色,说明产物中含有SO2气体,SO2 有漂白性;反应中生成了有毒的SO2气体,不能随意排放,故C装置后必须连接一个盛有NaOH溶液的尾气处理装置;
③氨气溶于水呈碱性,SO2 溶于水显酸性,两者将会反应,故要检验氨气的存在,必须先将SO2气体在B装置的球形干燥管中除去,可以使用碱石灰;氨气的水溶液显碱性,可以用紫色石蕊溶液检验,溶液呈蓝色,故答案为:碱石灰、紫色石蕊试液


科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1
2 H2(g)+ O2(g) 2H2O(g) ΔH2
C(s)+ O2(g) CO2(g) ΔH3
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
A. 12ΔH3+5ΔH2-2ΔH1 B. 2ΔH1-5ΔH2-12ΔH3
C. 12ΔH3-5ΔH2-2ΔH1 D. ΔH1-5ΔH2-12ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,如图(Ⅰ)所示:△H1=△H2+△H3 , 根据上述原理和图(Ⅱ)所示,判断各对应的反应热关系中不正确的是( ) 
A.A→F△H=﹣△H6
B.A→D△H=△H1+△H2+△H3
C.△H1+△H2+△H3+△H4+△H5+△H6=0
D.△H1+△H6=△H2+△H3+△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途具有对应关系的是
A.氨气易液化,可用作制冷剂
B.溴化银具有感光性,可用于人工降雨
C.氯化铁具有氧化性,可用了自来水的杀菌消毒
D.氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的说法中正确的是( )
A.氯化钾溶于水时离子键未被破坏
B.金属晶体中金属键越强,熔点越高
C.冰融化时分子中共价键发生断裂
D.分子间作用力越大,分子越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 形成离子键的阴阳离子间只存在静电吸引力
B. HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
C. 第三周期非金属元素含氧酸的酸性从左到右依次增强
D. 只要含有离子键的化合物就是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试完成以下问题:

(1)电源B极的名称是________。
(2)乙装置中电解反应的总化学方程式是________________________。
(3)如果收集甲装置中两极上析出的物质,两种物质的物质的量比是(阳极比阴极)________。
(4)欲用丙装置给铜镀银,G应该是____(填“铜”或“银”),电镀液的主要成分是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.在周期表中,主族元素所在的族序数等于原子的最外层电子数
B.电子云表示电子在原子核外运动的轨迹
C.最外层电子数为8的都是稀有气体元素的原子
D.元素的原子序数越大,其原子半径越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com