
【题目】下列说法中,正确的是( )
A.在周期表中,主族元素所在的族序数等于原子的最外层电子数
B.电子云表示电子在原子核外运动的轨迹
C.最外层电子数为8的都是稀有气体元素的原子
D.元素的原子序数越大,其原子半径越大
科目:高中化学 来源: 题型:
【题目】下列关于酸、碱、盐元素组成的说法中,正确的是( )
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作___________剂。
(2)自然界的Cr主要以+3价和+6价(Cr2O72-)存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为Cr3+。写出该离子方程式:_________________________________。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是____________________________________。
II.(NH4)2Fe(SO4)2·6H2O(莫尔盐,浅绿色)用作化学试剂、医药以及用于冶金、电镀等。某课题组通过实验检验莫尔盐晶体加热时的分解产物,回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_________________________。
(2)①甲同学提出猜想:分解产物可能是N2、Fe2O3、SO3、H2O四种物质。你是否同意并说明理由:_________________________________________。
②乙同学设计了如图装置,其中装置中的固体变为红棕色,则固体产物中含有___________;
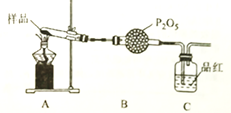
C装置中红色褪去,说明气体产物中含有_______;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是__________________(写一种即可)。
③丙同学想利用上述装罝证明分解产物中含有氨气,只需要更换B和C中的试剂即可,则更换后的试剂为B________________,C_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
![]()
(1)吸硫装置如图所示
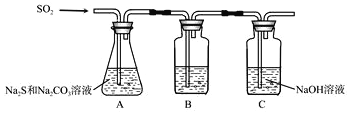
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是______,表明SO2吸收效率低的实验现象是B中溶液_________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是___________________。(答一条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。请完成该实验方案。(已知:室温时CaCO3饱和溶液的pH=10.2)
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, ______。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,_____。 | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=___mol·L-1。
(4)在(3)的实验中,某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能___________(填“不受影响”、“偏低”或“偏高”),原因是_____________。(用离子方程式表示)。(已知:IO3-+5I-+6H+= 3I2+3H2O,4I-+O2+4H+=I2+2H2O,2S2O32-+I2=S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“有效碰撞”的说法不正确的是( )
A.分子间的碰撞均为有效碰撞
B.能发生化学反应的碰撞叫做有效碰撞
C.发生有效碰撞时,化学键才能断裂
D.其他条件相同时,反应物浓度越大,单位时间内的有效碰撞次数越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
B. 相同质量的Na2O2和Na2S固体具有不相同的阴阳离子数和质子数
C. 5.8g正丁烷与异丁烷组成的混合气体中含有的C-H键数目为NA
D. 常温下CH3COONH4的pH=7,则0.5 mol﹒L-1的CH3COONH4溶液中,NH4+浓度为0.5 mol﹒L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g) ![]() CH3OH(g),现在实验室模拟该反应并进行分析。
CH3OH(g),现在实验室模拟该反应并进行分析。
(1) 下图是该反应在不同温度下CO的转化率随时间变化的曲线。

① 该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
② T1和T2温度下的平衡常数大小关系是K1_______K2(填 “>”、“<”或“=”)。
③ 若容器容积不变,下列措施可增加甲醇产率的是______________。
A. 升高温度 B. 将CH3OH(g)从体系中分离
C. 使用合适的催化剂 D. 充入He,使体系总压强增大
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示

下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小 ③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(3)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,下列各组离子能大量共存的是( )
A.K+、Fe3+、SO ![]() 、NO3﹣
、NO3﹣
B.Cu2+、Mg2+、SO ![]() 、Cl﹣
、Cl﹣
C.Ag+、Na+、NO3﹣、Cl﹣
D.K+、Na+、CO ![]() 、OH﹣
、OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com