
【题目】(硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
![]()
(1)吸硫装置如图所示
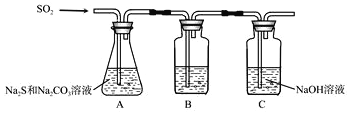
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是______,表明SO2吸收效率低的实验现象是B中溶液_________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是___________________。(答一条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。请完成该实验方案。(已知:室温时CaCO3饱和溶液的pH=10.2)
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, ______。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,_____。 | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=___mol·L-1。
(4)在(3)的实验中,某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能___________(填“不受影响”、“偏低”或“偏高”),原因是_____________。(用离子方程式表示)。(已知:IO3-+5I-+6H+= 3I2+3H2O,4I-+O2+4H+=I2+2H2O,2S2O32-+I2=S4O62-+2I-)
【答案】 品红溶液 颜色很快褪去 控制SO 2 的流速(或适当升高温度) 滴加足量稀硝酸后,再滴加少量AgNO3溶液,振荡 加入过量CaCl2溶液,搅拌,静置,用pH计测量上层清液pH值 3000a/107V 偏低 4I-+O2+4H+=2I2+2H2O,2S2O32-+I2=S4O62-+2I-
【解析】(1)①锥形瓶A中出来的气体中含有SO2 气体,检验SO2气体的试剂是品红溶液,如果品红溶液褪色很快,说明A中出来的气体中含有较高浓度的SO2 ,则A中SO2的吸收率较低,如果品红褪色比较慢,则说明A中SO2 吸收比较完全,故答案为:品红溶液、颜色很快褪去。
②为了使SO2 尽快完全吸收,除了及时搅拌反应物外,还可以适当提高反应的温度,使速率加快;也可以控制SO2 的流速,使反应速率增大。故答案为:适当提高反应的温度(或控制SO2 的流速)。
(2)①Cl-的检验所需要的试剂为AgNO3,同时CO32-和OH-也能与Ag+生成白色沉淀,从而干扰Cl-检验,故先必须将CO32-和OH-排除,所以先往溶液中加入过量的硝酸,使CO32-生成CO2气体挥发,OH-生成H2O,再加AgNO3 溶液,振荡,有白色沉淀生成可证明含有NaCl。故答案为:滴加足量稀硝酸后,再滴加少量AgNO3溶液,振荡。
②NaOH溶液呈碱性,可以用pH计测量其pH,如果pH>7,就可以说明混合物中含有NaOH,但Na2CO3溶液也呈碱性,故必须先将Na2CO3除去,可以加入过量的中性的CaCl2溶液生成CaCO3沉淀,同时生成的NaCl也为中性,再用pH计测量上层清液的pH。答案为:加入过量CaCl2溶液,搅拌,静置,用pH计测量上层清液pH值。
(3)根据IO3-+5I-+6H+= 3I2+3H2O, 2S2O32-+I2=S4O62-+2I-可得IO3- ~ 6S2O32-,Na2S2O3的物质的量为6×a/214 mol , c(Na2S2O3)=(6a/214)mol÷0.001VL=(3000a/107V )mol·L-1。
(4)第三步如果滴速过慢,则第二步中过量的I-被空气中的O2氧化生成I2,I2的量增多导致消耗的Na2S2O3溶液体积偏多,根据 c(Na2S2O3)= 3000a/107V mol·L-1可知,测得的浓度将偏低。对应的离子方程式为:4I-+O2+4H+=2I2+2H2O,2S2O32-+I2=S4O62-+2I-


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙。发生反应:
Ⅰ.WO42ˉ(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OHˉ(aq) K1
CaWO4(s)+2OHˉ(aq) K1
已知:反应Ⅰ的平衡常数K1理论值如下表,请回答下列问题:
温度/℃ | 25 | 50 | 90 | 100 |
K1 | 79.96 | 208.06 | 222.88 | 258.05 |
(1)判断反应Ⅰ的△S ______0、△H______0(填“>”、“=”或“<”),在______(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,溶解度均随温度升高而减小。它们在水中存在如下沉淀溶解平衡:
Ⅱ.CaWO4(s)![]() Ca2+(aq) + WO42ˉ(aq) K2
Ca2+(aq) + WO42ˉ(aq) K2
Ⅲ.Ca(OH)2(s)![]() Ca2+(aq) + 2OHˉ(aq) K3
Ca2+(aq) + 2OHˉ(aq) K3
①根据反应Ⅰ~Ⅲ,可推导出K1、K2与K3之间的关系,则K1=______(用K2、K3表示)。
②根据反应Ⅱ,右图为不同温度下CaWO4的沉淀溶解平衡曲线。则T1 ____T2(填“>”“=”或“<”)。T1时,向0.5 molLˉ1钨酸钠的碱性溶液中,加入适量Ca(OH)2,反应达到平衡后WO42ˉ的转化率为60%,此时溶液中c(Ca2+)=_______molLˉ1。(假设反应前后体积不变)

(3)制取钨酸钙时,适时向反应混合液中添加适量的某种酸性物质,有利于提高WO42ˉ的转化率。反应后过滤,再向滤液中通CO2,进一步处理得到Na2CO3。
①在反应混合液中不直接通入CO2,其理由是_____________;
②用平衡移动原理解释添加酸性物质的理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途具有对应关系的是
A.氨气易液化,可用作制冷剂
B.溴化银具有感光性,可用于人工降雨
C.氯化铁具有氧化性,可用了自来水的杀菌消毒
D.氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 形成离子键的阴阳离子间只存在静电吸引力
B. HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
C. 第三周期非金属元素含氧酸的酸性从左到右依次增强
D. 只要含有离子键的化合物就是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试完成以下问题:

(1)电源B极的名称是________。
(2)乙装置中电解反应的总化学方程式是________________________。
(3)如果收集甲装置中两极上析出的物质,两种物质的物质的量比是(阳极比阴极)________。
(4)欲用丙装置给铜镀银,G应该是____(填“铜”或“银”),电镀液的主要成分是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学化学知识计算:
(1)6.02×1022个Na+的物质的量为: .
(2)3molH2O的质量为: .
(3)同温同压下,同体积的CH4和CO2物质的量之比为; 分子个数之比;原子个数之比;质量比 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.在周期表中,主族元素所在的族序数等于原子的最外层电子数
B.电子云表示电子在原子核外运动的轨迹
C.最外层电子数为8的都是稀有气体元素的原子
D.元素的原子序数越大,其原子半径越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的叙述错误的是( )
A. 某H2SO4溶液中![]() =1.0×108,由水电离出的c(H+)=1×10-11 mol·L-1
=1.0×108,由水电离出的c(H+)=1×10-11 mol·L-1
B. 将0.02 mol·L-1 HCl溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合后,溶液pH约为12
C. 将0.1 mol·L-1的NaOH溶液加水稀释后,由水电离产生的c(H+)·c(OH-)保持不变
D. pH=3的H2SO4溶液,稀释105倍后,溶液的pH<7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com