
����Ŀ��Ϊ��֤±�ص��������Ե����ǿ����ijС������ͼ��ʾװ�ý���ʵ�飨�г���������ȥ���������Ѽ��飩�� 
ʵ����̣�
���ɼУ�����a���μ�Ũ���ᣮ
��B��C�е���Һ����Ϊ��ɫʱ���н����ɼУ�
��B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ���رջ���a��
������
��1��A�в�������ɫ���壬�仯ѧ����ʽ�� ��
��2����֤������������ǿ�ڵ��ʵ�������� ��
��3��B����Һ������Ӧ�����ӷ���ʽ�� ��
��4��Ϊ��֤���������ǿ�ڵ⣬���̢��IJ�����������
��5�����̢�ʵ���Ŀ����
��6���ȡ��塢�ⵥ�ʵ�������������ԭ��ͬ����Ԫ�ش��ϵ��� �� �õ�������������
���𰸡�
��1��16HCl��Ũ��+2KMnO4�T2MnCl2+2KCl+5Cl2��+8H2O
��2������KI��ֽ����
��3��Cl2+2Br���TBr2+2Cl��
��4������b��������C����Һ����D�У��رջ���b��ȡ��D�����ú�CCl4����Һ��Ϊ�Ϻ�ɫ
��5��ȷ��C�Ļ�ɫ��Һ����Cl2 �� �ų�Cl2�����û���ʵ��ĸ���
��6��ԭ�Ӱ뾶������
���������⣺��֤±�ص��������Ե����ǿ����װ��A�����������Һ��Ũ���ᷴӦ�����Ȼ��̡��Ȼ��ء�������ˮ��װ��A��������������ƿ�϶�ʪ��ĵ⻯�ص�����ֽ����ɫ����֤������������ǿ�ڵ⣬װ��B��װ��B��ʢ���廯�ƣ���������װ��B�У���������������Ϊ�嵥�ʣ���Һ�ʳȺ�ɫ����֤�ȵ�������ǿ���壬�����ж����ܱ������������գ������������Ƶ�����ֹ������Ⱦ��������B��C�е���Һ����Ϊ��ɫʱ���н����ɼУ�Ϊ��֤���������ǿ�ڵ⣬ʵ��ʱӦ���������ĸ��ţ���B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ��˵���д����������ɣ���ʱӦ�رջ���a����������������Ӱ��ʵ����ۣ�
��1.������ɫ����Ϊ�������ɸ�����غ�Ũ���ᷢ��������ԭ��Ӧ�����Ȼ��̡��Ȼ��ء�������ˮ������ʽΪ��16HCl��Ũ��+2KMnO4�T2MnCl2+2KCl+5Cl2��+8H2O���ʴ�Ϊ��16HCl��Ũ��+2KMnO4�T2MnCl2+2KCl+5Cl2��+8H2O��
��2.�����۱���ɫ��˵���е��ʵ����ɣ�˵������������ǿ�ڵ��ʵ⣬�ʴ�Ϊ������KI��ֽ������
��3.��������������ǿ���壬������ͨ��NaBr��Һ�л��е��������ɣ�������Ӧ�����ӷ���ʽΪ��Cl2+2Br���TBr2+2Cl�� �� �ʴ�Ϊ��Cl2+2Br���TBr2+2Cl����
��4.��Ϊ��֤���������ǿ�ڵ⣬Ӧ��C�����ɵ�����뵽ʢ��KI��Һ��D�У��緢��������ԭ��Ӧ��������CCl4����Һ��Ϊ�Ϻ�ɫ��
�ʴ�Ϊ������b��������C����Һ����D�У��رջ���b��ȡ��D��������CCl4����Һ��Ϊ�Ϻ�ɫ��
��5.��Ϊ��֤���������ǿ�ڵ⣬ʵ��ʱӦ���������ĸ��ţ���B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ��˵���д����������ɣ���ʱӦ�رջ���a����������������Ӱ��ʵ����ۣ��ʴ�Ϊ��ȷ��C�Ļ�ɫ��Һ����Cl2 �� �ų�Cl2�����û���ʵ��ĸ��ţ�
��6.����ͬһ����Ԫ�أ����ϵ��£����Ӳ����������࣬ԭ�Ӱ뾶������Ԫ�صĽ���������ǿ���õ��������������ʴ�Ϊ��ԭ�Ӱ뾶������
��֤±�ص��������Ե����ǿ����װ��A�����������Һ��Ũ���ᷴӦ�����Ȼ��̡��Ȼ��ء�������ˮ��װ��A��������������ƿ�϶�ʪ��ĵ⻯�ص�����ֽ����ɫ����֤������������ǿ�ڵ⣬װ��B��װ��B��ʢ���廯�ƣ���������װ��B�У���������������Ϊ�嵥�ʣ���Һ�ʳȺ�ɫ����֤�ȵ�������ǿ���壬�����ж����ܱ������������գ������������Ƶ�����ֹ������Ⱦ��������B��C�е���Һ����Ϊ��ɫʱ���н����ɼУ�Ϊ��֤���������ǿ�ڵ⣬ʵ��ʱӦ���������ĸ��ţ���B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ��˵���д����������ɣ���ʱӦ�رջ���a����������������Ӱ��ʵ����ۣ���1��������ɫΪ����ɫ��������ؾ���ǿ�����ԣ���Ũ���ᷴӦ������������2������������ǿ�ڵ��ʵ⣬�������۱���ɫ����3��������������ǿ���壬������ͨ��NaBr��Һ�л��е��������ɣ���4����CCl4����Һ��Ϊ�Ϻ�ɫ����˵���е����ɣ���5��Ϊ��֤���������ǿ�ڵ⣬ʵ��ʱӦ���������ĸ��ţ���6����ԭ�ӽṹ�����Ӳ�����ԭ�Ӱ뾶���ĽǶȷ�����


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵ����ı����д������(����)
A. 0.3 mol���� B. 1.5 mol���� C. 1 mol�� D. 0.5 mol��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����������������ͭ��Ӧ������ˮ�����Ҳ��������������ͭ��Ӧ�������ǣ� ��
A.������B.��ѿ��C.��������D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����������������
A.��ȫȼ�ղ���ֻ�ж�����̼��ˮ
B.���Ǽ���������ˮ
C.���ӵ�ͨʽΪCnH2n+2������������ȡ����Ӧ
D.�����Ƿǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ���л��ϳ��г����ڱ����ʻ�����Ϊ�ϳ��м��壬ͬʱ����һ����Ҫ�����ϣ��㷺Ӧ���ڻ�ױƷ��ʳ����ϵ���ҵ��G��һ�ֳ��õ���ȩ�������к���һ����Ԫ����һ����Ԫ���ṹ��������G��һ�ֺϳ�·�ߣ�
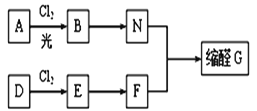
��֪���ٷ�����A����Ԫ�ص���������Ϊ8.7%��A������ͼ�У��������ӷ��Ӧ������ʺɱ�Ϊ92�� D�IJ��ؿ�����������һ�����ҵ�ʯ�ͻ�����չˮƽ��
��ͬһ��̼ԭ�����������ǻ����ȶ�������ˮ�γ��ʻ���
��
�ش��������⣺
��1��A�Ľṹ��ʽ��_____________________��E��������____________________________��
��2����D����E�ķ�Ӧ������________��E��F�ķ�Ӧ������_________________________��
��3����B����N�Ļ�ѧ����ʽΪ___________________________��
��4�����о����֣�ά����C������Ϊ�ϳ�G���ʵĴ��������м�����Ч�ʸߡ���Ⱦ���ٵ��ŵ㡣ά����C�Ľṹ����ͼ����ά����C�����к�������������Ϊ_____________��

��5����ȩG�Ľṹ��ʽΪ______________��G�ж���ͬ���칹�壬д��������ͬʱ������������������ͬ���칹��Ľṹ��ʽ��_________________________��
�ټ��ܷ���������Ӧ��������FeC13������ɫ��Ӧ���ں˴Ź�����гΪ4��塣
��6��д����2-��ϩΪԭ�ϣ��������Լ���ѡ���Ʊ�˳����˳ʽ��1,3-����ϩ���ĺϳ�·�ߣ�__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������;������ȡ������������ͭ��
��ͭ��ϡ���ᷴӦ����ͭ��Ũ���ᷴӦ����ͭ����������Ӧ��������ͭ������ͭ�ٸ����ᷴӦ��
������������ȷ���ǣ� ��
A.����;�������ĵ�ͭ���������
B.�����ĵ���������ʵ����Ǣ٣��ڣ���
C.;���۵��Ʊ�����������ϡ���ɫ��ѧ�������
D.;�����б�������ͭ�뱻��ԭ����������ʵ�������3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����������Ļ����Һ��ȡ��10mL��������BaCl2��Һ�����ˡ�ϴ�ӡ���ɺ�õ�9.32g�ij�������Һ��4.0molL��1NaOH��Һ��Ӧ����ȥ35mL��Һʱǡ����ȫ�кͣ�����
��1�����Һ��H2SO4��HNO3�����ʵ���Ũ�ȸ��Ƕ��٣�
��2����ȡ10mLԭ���Һ������3.2gͭ�۹���ʱ���ڱ�״�����ռ�����������Ϊ���ٺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A. ������Һ�У�Al3+��Ba2+��Cl-��NO3-
B. �����£�pH=1����Һ�У�K+��Fe2+��MnO4-��I-
C. ��ʹ���ȱ�Ϊ��ɫ����Һ�У�Na+��Al3+��Cl-
D. �����£�![]() =1��10-12����Һ�У�K+��Na+��CO32-��NO3-
=1��10-12����Һ�У�K+��Na+��CO32-��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ԫ��X��Y��Z��W��RΪǰ������Ԫ�أ���ԭ��������������X��̬ԭ�Ӻ���������δ�ɶԵ��ӣ�Z��W�ֱ��Ƕ������е縺��������С��Ԫ�أ�R2+���ӵ�3d����������ԳɶԵ��ӡ���ش�����������
��1��R��̬ԭ�ӵĵ����Ų�ʽΪ__________��Ԫ��X��Y��Z�ĵ�һ�������ɴ�С��˳��Ϊ����Ԫ�ط��ű�ʾ��___________________��
��2��������XZ3�Ŀռ乹��Ϊ______��R2+��NH3�γɵ��������У��ṩ�¶Ե��ӵ���_____��
��3��Z���⻯���ɹ����Ϊ��̬����˷����������������________��
��4��Z��W��R�γ�ij�ֻ�����ľ����ṹ����ͼ��ʾ���仯ѧʽΪ___________��

��5��XY2���ܱ�����KMnO4��Һ����������MnO4������ԭΪMn2+����Ӧ�����ӷ���ʽ��________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com