
【题目】化学耗氧量(Chemical Oxygen Demand,简称COD),是一个量度水体受污染程度的重要指标.废水中的还原性物质大部分是有机物,COD表示为氧化这些还原性物质所需消耗的O2的量(以mgL﹣1记).下面是用KMnO4法测定水样中COD的实验: 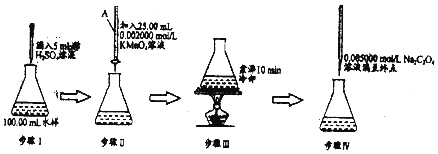
已知:步骤 IV 的离子反应为2MnO4﹣+5C2C42﹣+16H+=2Mn2++10CO2↑+8H2O
(1)步骤Ⅱ滴定管中注入酸性高锰酸钾前,先用蒸馏水洗净,再 .
(2)步骤 IV实验过程中滴入第一滴Na2C2O4溶液时褪色较慢,以后的滴定中褪色较快,原因是 .
(3)若步骤 IV所用Na2C2O4溶液为20.00mL,根据相关数据计算该水样的化学耗氧量COD(以mgL﹣1记).写出计算过程 .
(4)若实验测量结果(COD值)比实际值偏高,可从以下两个方面猜想:
猜想1:水样中Cl﹣影响;
猜想2:步骤 IV其他操作都正确,滴定终点(填“仰”“俯”)视读数.
【答案】
(1)用KMnO4标准溶液润洗2﹣3次
(2)随着反应的进行,生成的Mn2+可作为反应的催化剂
(3)4mg/L
(4)俯
【解析】解:(1)滴定管中注入酸性高锰酸钾前应先用蒸馏水洗涤,后再用KMnO4标准溶液润洗2﹣3次;所以答案是:用KMnO4标准溶液润洗2﹣3次;(2)步骤 IV实验过程中滴入第一滴Na2C2O4溶液时褪色较慢,以后的滴定中褪色较快,说明反应中生成的锰离子对反应起到催化剂的作用,所以答案是:随着反应的进行,生成的Mn2+可作为反应的催化剂;(3)设过量的KMnO4物质的量为x,由
2MnO4﹣+ | 5C2C42﹣+ | 16H+= | 2Mn2++ | 10CO2↑+ | 8H2O |
2 | 5 | ||||
x | 0.00500mol/L×0.02L |
则x= ![]() =4×10﹣5mol
=4×10﹣5mol
所以与水样反应的KMnO4为0.00200mol/L×25×10﹣3L﹣4×10﹣5mol=10﹣5mol
MnO4﹣生成Mn2+得5e﹣ , O2生成H2O得4e﹣ , 根据得失电子守恒,与水样反应的KMnO4转化成消耗氧气的量为=10﹣5mol× ![]() =1.25×10﹣5mol,
=1.25×10﹣5mol,
化学耗氧量COD值为 ![]() =4mg/L,所以答案是:4mg/L;(4)实验测量结果比实际有机物含量偏高,配制Na2C2O4标液定容时,可能是读取数据时把滴定管中消耗溶液体积读大了;
=4mg/L,所以答案是:4mg/L;(4)实验测量结果比实际有机物含量偏高,配制Na2C2O4标液定容时,可能是读取数据时把滴定管中消耗溶液体积读大了;
所以答案是:俯.


科目:高中化学 来源: 题型:
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是( )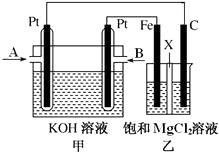
A.甲中A处通入CH4 , 电极反应式为CH4+10OH??8e? ![]()
![]() +7H2O
+7H2O
B.乙中电解MgCl2溶液的总反应为2Cl?+2H2O ![]() Cl2↑+H2↑+2OH?
Cl2↑+H2↑+2OH?
C.理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D.甲、乙中电解质溶液的pH都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的性质说法中不正确的是
A. 当光线照射胶体时可产生光亮的通路
B. 胶体具有吸附性,可以用作净水剂
C. 胶体区别于其它分散系的因素是胶体粒子的大小
D. 胶体是胶状物体,可以用肉眼也可以用光照鉴别出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化碘(ICl)的化学性质与氯气相似,预计它与NaOH溶液反应的最初生成物可能是
A. NaCl和NaIO B. NaClO和NaI C. NaCl和NaI D. NaClO和NaIO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
B. 小苏打溶液中加入过量的澄清石灰水:Ca2++2OH-+2HCO![]() ===CaCO3↓+ CO
===CaCO3↓+ CO![]() +2H2O
+2H2O
C. 纯碱溶液中滴加少量盐酸:CO32-+H+===HCO![]()
D. 用FeCl3溶液腐蚀铜电路板:Fe3++ Cu === Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的酸性溶液中,能共存的离子组是( )
A. Na+ 、K+、SO42-、HCO3B. Na+、 K+、Cl、NO3
C. Ba2+、K+、SO42-、NO3D. Fe3+、K+、SO42-、Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于阿伏伽德罗常数NA , 下列叙述正确的是( )
A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B.1.0L0.1 molL﹣1 AlCl3溶液中所含的Al3+离子数为0.1NA
C.标准状况下,11.2LSO3中含有分子数目为0.5NA
D.常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2由于其具有咸味且价格便宜,常在非法食品制作时用作食盐的不合理替代品,因为亚硝酸钠有毒,含有工业盐的食品对人体危害很大,有致癌性.
(1)亚硝酸钠可少量添加到食物中,用作食品的
(2)已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,该述反应的还原剂是 , 若反应中转移0.2mol电子,则参与反应的NaNO2为mol
(3)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:
A.水
B.碘化钾淀粉试纸
C.淀粉
D.食醋
E.白酒
(4)实验室模拟用以下反应合成亚硝酸盐
C6H12O6+12HNO3=3HOOC﹣COOH+9NO2+3NO↑+9H2O
NO+NO2+2NaOH=2NaNO2+2H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
其中第一个反应要控制反应液的温度在35~60℃条件下进行,原因是 , 第二个和第三个反应是NaOH溶液吸收反应生产的气体,所得溶液中的阴离子共有三种OH﹣、NO2﹣、 , 且第三种离子与NO2﹣的浓度之比为 .
(5)亚硝酸钠能氧化酸性条件下的Fe2+ , 同时产生一种气体,该气体在空气中迅速变色,写出亚硝酸钠与亚铁离子反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com