
【题目】关于阿伏伽德罗常数NA , 下列叙述正确的是( )
A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B.1.0L0.1 molL﹣1 AlCl3溶液中所含的Al3+离子数为0.1NA
C.标准状况下,11.2LSO3中含有分子数目为0.5NA
D.常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA
【答案】D
【解析】解:A.0.1molCl2溶于水,只有部分氯气与水反应,则转移电子的物质的量小于0.1mol,转移电子的数目小于0.1NA , 故A错误;
B.1.0L0.1 molL﹣1 AlCl3溶液中含有氯化铝的物质的量为0.1mol,由于铝离子发生水解,导致溶液中铝离子的物质的量小于0.1mol,溶液中所含的Al3+离子数小于0.1NA , 故B错误;
C.标准状况下,SO3不是气体,不能根据标准状况下的气体摩尔体积计算,故C错误;
D.3.2gO2和O3混合气体中含有3.2g氧原子,含有氧原子的物质的量为: ![]() =0.2mol,含有的氧原子数目为0.2NA , 故D正确;
=0.2mol,含有的氧原子数目为0.2NA , 故D正确;
故选D.


科目:高中化学 来源: 题型:
【题目】氨是重要的氮肥,合成原理为:N2(g)+3H2(g) ![]() 2NH3(g)△H=﹣92.4kJ/mol.回答下列问题:
2NH3(g)△H=﹣92.4kJ/mol.回答下列问题:
(1)写出平衡常数K的表达式 , 如果降低温度,该反应K值 , 化学反应速率 , N2的转化率(填“增大”、“减小”或“不变”).
(2)在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题: 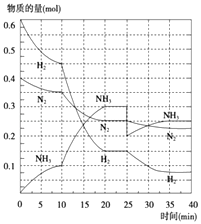
①10min内以NH3表示的平均反应速率: .
②在10~20min内,NH3浓度变化的原因可能是
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
③第1次达到平衡的时间为: , 第2次达到平衡的时间为:;
④在反应进行至25min时,曲线发生变化的原因
A.缩小容器体积 B.降低温度 C.分离了部分NH3
达第二次平衡时,新平衡的平衡常数K2K1 ,
(填“大于”、“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学耗氧量(Chemical Oxygen Demand,简称COD),是一个量度水体受污染程度的重要指标.废水中的还原性物质大部分是有机物,COD表示为氧化这些还原性物质所需消耗的O2的量(以mgL﹣1记).下面是用KMnO4法测定水样中COD的实验: 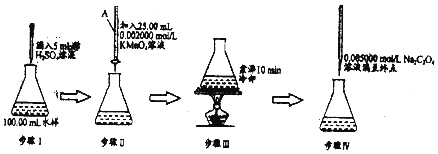
已知:步骤 IV 的离子反应为2MnO4﹣+5C2C42﹣+16H+=2Mn2++10CO2↑+8H2O
(1)步骤Ⅱ滴定管中注入酸性高锰酸钾前,先用蒸馏水洗净,再 .
(2)步骤 IV实验过程中滴入第一滴Na2C2O4溶液时褪色较慢,以后的滴定中褪色较快,原因是 .
(3)若步骤 IV所用Na2C2O4溶液为20.00mL,根据相关数据计算该水样的化学耗氧量COD(以mgL﹣1记).写出计算过程 .
(4)若实验测量结果(COD值)比实际值偏高,可从以下两个方面猜想:
猜想1:水样中Cl﹣影响;
猜想2:步骤 IV其他操作都正确,滴定终点(填“仰”“俯”)视读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是( ) 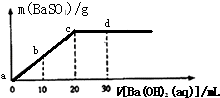
A.a﹣d溶液的pH:a<b<c<d
B.a﹣d溶液的导电能力:a<b<c<d
C.b处溶液的c(H+)与d处溶液的c(OH﹣)相等
D.c处溶液和d处溶液均呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国里昂的科学家最近发现一种只有四个中子构成的粒子,这种粒子被称为“四中子”,也有人称为“零号元素”。下列关于“四中子”粒子的说法不正确的是
A. 该粒子不显电性 B. 该粒子质量数为4
C. 该粒子质量比氢原子大 D. 在周期表中与氢元素在同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是______________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式____________________________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在对水消毒时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有_____________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法
表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:
NaClO3+ HCl(浓)- ClO2↑+ Cl2↑+ H2O+ NaCl.
①配平方程式:______________。
②浓盐酸在反应中显示出来的性质是__________________(填序号)。
A.还原性 B.氧化性 C.酸性
③若上述反应中产生0.1molClO2,则转移的电子数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为( )
A.v(O2)=0.01mol/(Ls)
B.v(NO)=0.08mol/(Ls)
C.v(H2O)=0.003mol/(Ls)
D.v(NH3)=0.001mol/(Ls)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com