

分析 由题给信息可知铝和锌性质相似,则都可碱溶液反应,试剂A为NaOH溶液,沉淀A为Mg,滤液B为NaAlO2和Na2ZnO2,试剂B为稀硫酸,可生成Zn(OH)2、Al(OH)3沉淀,即沉淀B,因Zn(OH)2溶于氨水而氢氧化铝不溶,则试剂C为氨水,沉淀C为Al(OH)3,滤液B含有[Zn(NH3)4]2+,分别加入稀硫酸生成Zn2+、NH4+
,在加入适量NaOH溶液可生成Zn(OH)2,即沉淀D,滤液C含有硫酸铵,以此解答该题.
解答 解:由题给信息可知铝和锌性质相似,则都可碱溶液反应,试剂A为NaOH溶液,沉淀A为Mg,滤液B为NaAlO2和Na2ZnO2,试剂B为稀硫酸,可生成Zn(OH)2、Al(OH)3沉淀,即沉淀B,因Zn(OH)2溶于氨水而氢氧化铝不溶,则试剂C为氨水,沉淀C为Al(OH)3,滤液B含有[Zn(NH3)4]2+,分别加入稀硫酸生成Zn2+、NH4+
,在加入适量NaOH溶液可生成Zn(OH)2,即沉淀D,滤液C含有硫酸铵,
(1)由以上分析可知试剂A为NaOH溶液,B为稀硫酸,C为稀氨水,故答案为:NaOH溶液;稀硫酸;稀氨水;
(2)由以上分析可知沉淀A为Mg,C为Al(OH)3,D为Zn(OH)2,故答案为:Mg;Al(OH)3;Zn(OH)2.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及题给信息,为解答该题的关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
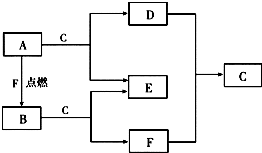 A、D、F均是由短周期元素组成的单质,常温下C是液体.
A、D、F均是由短周期元素组成的单质,常温下C是液体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成3n mol X,同时消耗n mol Y | |
| B. | X的生成速率与Z的消耗速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | X、Y、Z的物质的量之比为3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁的化学式:FeO | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 | |
| D. | 质子数为53,中子数为78的碘原子表示为:${\;}_{53}^{131}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ④⑥ | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
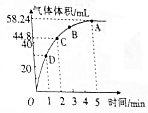 取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略) | 序号 | 条件 | 现象和结论 | |
| 温度/℃ | 催化剂 | ||
| 1 | 40 | FeCl3溶液 | |
| 2 | 20 | FeCl3溶液 | |
| 3 | 20 | MnO2 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com