
【题目】下列关于各实验装置图的叙述中正确的是
A. 构成锌铜原电池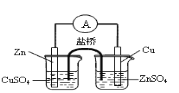
B. 实验室制氨气并收集干燥氨气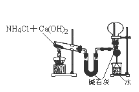
C. 验证溴乙烷发生消去反应生成烯烃
D. 由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>苯酚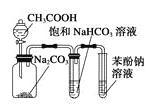
【答案】BD
【解析】
A项,应将锌插入硫酸锌,铜插入硫酸铜溶液中;B项,收集干燥氨气,在用水吸收氨气前面、收集装置后面连接盛有碱石灰的干燥管;C项,应在两装置中间加一个除去乙醇蒸气的装置,错误;CH3COOH酸性强于H2CO3、H2CO3强于苯酚,要用饱和碳酸氢钠溶液除去乙酸,排除乙酸的干扰。
A.应将锌插入硫酸锌,铜插入硫酸铜溶液中,否则锌置换铜,能形成原电池反应,但不能形成电流,错误;B.收集氨气后面连接盛有碱石灰的干燥管,可以防止用水吸收氨气的装置中水蒸气进入收集的氨气中,得到干燥的氨气,正确;C.乙醇易挥发,其能与酸性高锰酸钾溶液反应,应先除去乙醇,错误;D.乙酸和碳酸钠溶液反应生成二氧化碳气体,用饱和碳酸氢钠除去挥发的醋酸,二氧化碳气体通入到苯酚钠溶液,溶液变浑浊,可说明酸性CH3COOH>H2CO3>C6H5OH,正确。
故选BD。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 漂白粉溶液漂白的原理是与空气中的CO2反应生成次氯酸
B. 84消毒液的主要成分是次氯酸钠
C. 金属钠保存在煤油中
D. 久置氯水酸性会减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学用含有少量泥沙、CaCl2、MgCl2、Na2SO4的粗盐制取纯净的NaCl,实验前他们设计了如图方案(框图)
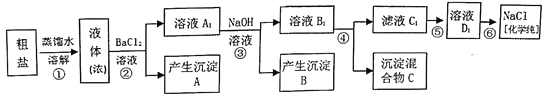
(1)请写出操作第④步所加试剂名称及第②步操作名称:
④_____________________,②___________________________。
(2)写出第⑤步操作中可能发生反应的离子方程式:____________________。
(3)如何检验第②步操作中硫酸根离子已完全除尽:_____________________。
(4)你认为该设计里哪些步骤调换后不影响实验结果:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四组分散系:①汽油和水形成的乳浊液、②含有泥沙的食盐水、③溶有溴(Br2)的溴化钾溶液、④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表)。请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是
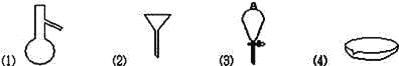
A. ![]() 分液 B.
分液 B. ![]() 过滤 C.
过滤 C. ![]() 萃取 D.
萃取 D. ![]() 蒸馏
蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 盐酸与氨水反应:H++OH-=H2O
B. 铜粉与稀硝酸的反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
C. Cl2与H2O的反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D. 碳酸钙溶液与足量稀盐酸的反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为“铁链环”结构,图中两环相交部分A、B、C、D表示物质间的反应。下列对应部分反应的离子方程式书写不正确的是
![]()
A. C12+2OH-=Cl-+ClO-+2H2O
B. Cu2++2OH-=Cu(OH)2↓
C. SO42-+Ba2+=BaSO4↓
D. OH-+HCO3-=H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 由反应SiO2+2C ![]() Si+2CO↑,可得出C的非金属性强于Si
Si+2CO↑,可得出C的非金属性强于Si
B. 由分子组成的物质中一定存在共价键
C. 对于平衡2HI(g)![]() I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变
I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变
D. 水的电离是吸热过程,升高温度,水的离子积增大、pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是( )
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D. T2℃时,若反应达平衡后再缩小容器的体积。c(N2)/c(NO)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量混合气体在密闭容器中发生反应:xA(g)+yB(g)![]() zC(g)+Q,平衡后测得A气体浓度为0.5mol·L-1;当恒温下将密闭容器的容积变为原来的两倍后再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
zC(g)+Q,平衡后测得A气体浓度为0.5mol·L-1;当恒温下将密闭容器的容积变为原来的两倍后再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
A.平衡向右移动 B.x+y>z
C.B的转化率提高 D.C的体积分数增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com