
【题目】以乙炔为原料,根据以下流程信息,制备有机物F;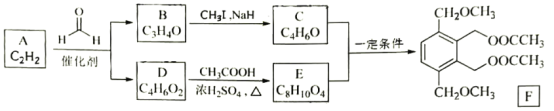
已知: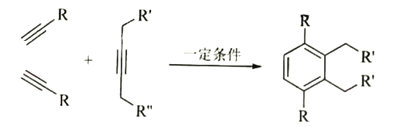
回答以下问题:
(1)A的化学名称为___。
(2)B的结构简式为___,C中官能团的名称是___。
(3)由A生成D的反应类型为___。
(4)由C和E生成F的化学方程式为____。
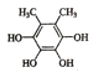
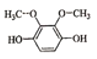
(5)芳香化合物X是E的同分异构体,可与FeCl3溶液发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为6:2:2。写出两种符合要求X的结构简式____、___。
(6)写出以1—溴—2—苯基乙烷为原料制备化合物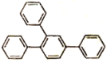 的合成销路线(其他试剂任选)。___。
的合成销路线(其他试剂任选)。___。
【答案】乙炔 HC![]() C—CH2OH 碳碳三键、醚键 加成反应 2HC
C—CH2OH 碳碳三键、醚键 加成反应 2HC![]() C—CH2OCH3+CH3COOCH2—C
C—CH2OCH3+CH3COOCH2—C![]() C—CH2OOCCH3
C—CH2OOCCH3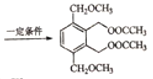
 、
、 (任写一种)
(任写一种) 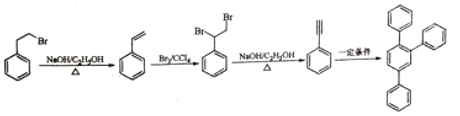
【解析】
A的分子式为C2H2,则A为HC![]() CH,结合B的分子式可知,乙炔和甲醛发生加成反应生成B和D,结合B和D的分子式可知,可知B为HC
CH,结合B的分子式可知,乙炔和甲醛发生加成反应生成B和D,结合B和D的分子式可知,可知B为HC![]() C—CH2OH,D为HOCH2—C
C—CH2OH,D为HOCH2—C![]() C—CH2OH;根据B→C中反应条件及C的分子式可知,发生了取代反应生成HC
C—CH2OH;根据B→C中反应条件及C的分子式可知,发生了取代反应生成HC![]() C—CH2OCH3;根据D→E及E的分子式,结合信息可知E为CH3COOCH2—C
C—CH2OCH3;根据D→E及E的分子式,结合信息可知E为CH3COOCH2—C![]() C—CH2OOCCH3;最后根据已知信息可知二者发生反应生成目标产物F。
C—CH2OOCCH3;最后根据已知信息可知二者发生反应生成目标产物F。
(1)A为HC![]() CH,化学名称为:乙炔,故答案为:乙炔;
CH,化学名称为:乙炔,故答案为:乙炔;
(2)由分析可知,B为HC![]() C—CH2OH,C为HC
C—CH2OH,C为HC![]() C—CH2OCH3,含碳碳三键、醚键两种官能团,故答案为:HC
C—CH2OCH3,含碳碳三键、醚键两种官能团,故答案为:HC![]() C—CH2OH;碳碳三键、醚键;
C—CH2OH;碳碳三键、醚键;
(3)1分子A(HC![]() CH)和2分子HCHO反应得到1molD(HOCH2—C
CH)和2分子HCHO反应得到1molD(HOCH2—C![]() C—CH2OH),为加成反应,故答案为:加成反应;
C—CH2OH),为加成反应,故答案为:加成反应;
(4)C为HC![]() C—CH2OCH3,E为CH3COOCH2—C
C—CH2OCH3,E为CH3COOCH2—CC—CH2OOCCH3,C和E发生类似“已知”的反应得到F,反应的化学方程式为2HC
![]() C—CH2OCH3+CH3COOCH2—C
C—CH2OCH3+CH3COOCH2—C![]() C—CH2OOCCH3
C—CH2OOCCH3 ,故答案为:2HC
,故答案为:2HC![]() C—CH2OCH3+CH3COOCH2—C
C—CH2OCH3+CH3COOCH2—C![]() C—CH2OOCCH3
C—CH2OOCCH3 ;
;
(5)E为CH3COOCH2—C![]() C—CH2OOCCH3,不饱和度为4,X是E的同分异构体:
C—CH2OOCCH3,不饱和度为4,X是E的同分异构体:
可与FeCl3溶液发生显色反应,则X含![]() ,不含其它不饱和结构,核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为6:2:2,则必含两个对称的甲基,酚羟基为2个或者4个,且每两个酚羟基处于对称位置,符合条件的有
,不含其它不饱和结构,核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为6:2:2,则必含两个对称的甲基,酚羟基为2个或者4个,且每两个酚羟基处于对称位置,符合条件的有 、
、 、
、 ,故答案为:
,故答案为: ;
; 、
、 (任写一种);
(任写一种);
(6)逆合成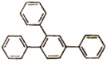 可由3分子
可由3分子![]() 发生类似“已知”反应得到,
发生类似“已知”反应得到,![]() 可由
可由 发生消去反应得到,
发生消去反应得到, 可由
可由![]() 和Br2加成得到,
和Br2加成得到,![]() 可由1—溴—2—苯基乙烷(
可由1—溴—2—苯基乙烷(![]() )发生消去反应得到,即流程为:
)发生消去反应得到,即流程为: ,故答案为:
,故答案为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
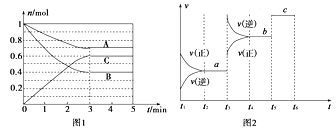
(1)该反应的化学方程式为____________________________。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是______________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
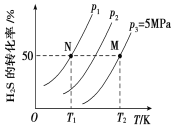
(1)△H_________ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为________________。
(3)图中M点的平衡常数Kp =_______MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
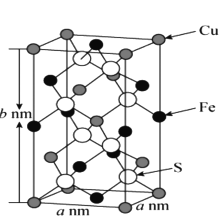
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜,请回答下列问题。
(l)基态硫原子中核外电子有____种空间运动状态。Fe2+的电子排布式是 ___。
(2)液态SO2可发生白偶电离2SO2=SO2++SO32-,SO32-的空间构型是 ___,与SO2+互为等电子体的分子有____(填化学式,任写一种)。
(3)CuCl熔点为426℃,融化时几乎不导电,CuF的熔点为908℃,沸点1100℃,都是铜(I)的卤化物,熔沸点相差这么大的原因是 ___。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____。乙硫醇的沸点比乙醇的沸点____(填“高”或“低”),原因是____。
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是 ___,其密度为 ___g/cm3(阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g) ![]() 2Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是( )
2Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是( )
A.10min内,消耗0.2 mol X,生成0.4 mol Z
B.第10min时,X的反应速率为0.01 mol·Lˉ1·minˉ1
C.10min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1
D.10min内,X和Y反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
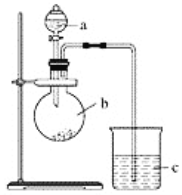
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制氢技术原理如图所示,下列说法正确的是( )
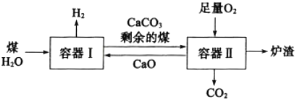
A.向容器Ⅰ中加入CaO能有效实现H2与CO2的分离
B.因为容器Ⅰ中还有剩余的煤,可以判断煤和H2O的反应为可逆反应
C.剩余的煤进入容器Ⅱ,可利用其与O2反应放出的热量分解CaCO3
D.煤中含有的硫元素在容器Ⅱ中最终转化为CaSO3进入炉渣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活离不开化学,以下是补铁剂和胃药的两张标签的部分信息。
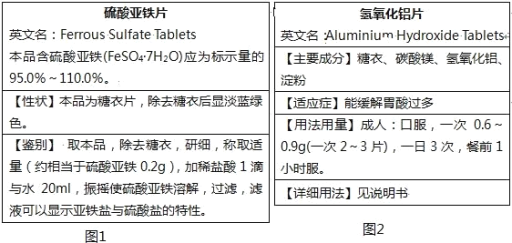
(1)根据“硫酸亚铁片”标签如图1回答:
①硫酸亚铁片中,糖衣的作用是_______;
②检验硫酸亚铁是否被氧化的试剂是_______;
③硫酸盐的鉴别反应的离子方程式是______;
④鉴别中,“加稀盐酸1滴”的作用是_______(选填序号);
A.防止亚铁离子被氧化 B.抑制亚铁离子水解
(2)根据氢氧化铝片标签如图2回答:
①能缓解胃酸过多的有效成分是______;
②写出氢氧化铝中和胃酸反应的离子方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com