
����Ŀ����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ�� 
��1������������������ȷ˳���ǣ�E�� �� �� �� �� �� ��F��
��2�����巢��װ���н��еķ�Ӧ��ѧ����ʽ������0.5mol MnO2���뷴Ӧʱ����������HCl������Ϊ �� ���ɵ�Cl2�ڱ�״���µ����ԼΪ ��
��3����װ���У��ٱ���ʳ��ˮ�������� �� ��Ũ����������� ��
��4����ѧʵ���м����Ƿ���Cl2��������ʪ��ĵ��۩�KI��ֽ�������Cl2�������ɹ۲쵽�������� �� д����Ӧ����ʽ ��
��5��д��β������װ���н��еķ�Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��C��D��A��B��H��G
��2��4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O��36.5g��11.2L
MnCl2+Cl2��+2H2O��36.5g��11.2L
��3����ȥCl2�е�HCl����������
��4����ֽ������Cl2+2KI=I2+2KCl
��5��Cl2+2NaOH=NaCl+NaClO+H2O
���������⣺��1����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿������������Ҫ����װ�������������ñ���ʳ��ˮ��ȥ�Ȼ��⣬ͨ��Ũ�����ȥˮ�����������ܳ����̴��ռ����������������������Һ���ն����������װ������˳���� E C D A B H G F�����Դ��ǣ�C D A B H G����2������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ����ѧ����ʽ��4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O����Ӧ������1mol�������̣���2mol�Ȼ��ⱻ����������1mol���������Ե�0.5mol MnO2���뷴Ӧʱ����������HCl������Ϊ1mol������Ϊ36.5g���������������ʵ���Ϊ0.5mol���������������Ϊ0.5mol��22.4L/mol=11.2L�����Դ��ǣ�4HCl��Ũ��+MnO2
MnCl2+Cl2��+2H2O����Ӧ������1mol�������̣���2mol�Ȼ��ⱻ����������1mol���������Ե�0.5mol MnO2���뷴Ӧʱ����������HCl������Ϊ1mol������Ϊ36.5g���������������ʵ���Ϊ0.5mol���������������Ϊ0.5mol��22.4L/mol=11.2L�����Դ��ǣ�4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O�� 36.5g�� 11.2L����3�������ӷ�����ȡ�������к����Ȼ����ˮ�����������ڱ���ʳ��ˮ���ܽ�Ȳ����Ȼ���������ˮ��ѡ��ʳ��ˮ��ȥ�����е��Ȼ��⣻ Ũ���������ˮ�ԣ�ѡ��Ũ��������������������������Դ��ǣ��ٳ�ȥCl2�е�HCl�� �ڸ�����������4����������ǿ�������ԣ��ܹ������⻯�����ɵ��ʵ⣬��ѧ����ʽ����Cl2+2 KI=I2+2 KCl�����������۱��������Դ��ǣ���ֽ������Cl2+2 KI=I2+2 KCl����5������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ����ѧ����ʽ��Cl2+2 NaOH=NaCl+NaClO+H2O�����Դ��ǣ�Cl2+2 NaOH=NaCl+NaClO+H2O��
MnCl2+Cl2��+2H2O�� 36.5g�� 11.2L����3�������ӷ�����ȡ�������к����Ȼ����ˮ�����������ڱ���ʳ��ˮ���ܽ�Ȳ����Ȼ���������ˮ��ѡ��ʳ��ˮ��ȥ�����е��Ȼ��⣻ Ũ���������ˮ�ԣ�ѡ��Ũ��������������������������Դ��ǣ��ٳ�ȥCl2�е�HCl�� �ڸ�����������4����������ǿ�������ԣ��ܹ������⻯�����ɵ��ʵ⣬��ѧ����ʽ����Cl2+2 KI=I2+2 KCl�����������۱��������Դ��ǣ���ֽ������Cl2+2 KI=I2+2 KCl����5������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ����ѧ����ʽ��Cl2+2 NaOH=NaCl+NaClO+H2O�����Դ��ǣ�Cl2+2 NaOH=NaCl+NaClO+H2O��
�����㾫����ͨ���������������ʵ�����Ʒ�������ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O�����Խ����⣮


 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ���ж����壬������ʹ�������б����ֹй¶��������Һ�ȵĸ�ƿ����й¶��������ȡ�Ĵ�ʩ�д�����ǣ���
A.�ý���ˮ��ë����ס�ڱ�B.����Ⱥ�������ɢ
C.����Ⱥ��ʹ���ɢD.��й¶�ص���һЩʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ��ķ�Ӧ���£�N2��g��+3H2��g��2NG3��g���� ij�¶��£����ݻ��㶨Ϊ2.0L���ܱ������г���2.0molN2��2.0molH2 �� һ��ʱ���Ӧ��ƽ��״̬��ʵ���������±���ʾ��
t/s | 0 | 50 | 150 | 250 | 350 |
n��NH3�� | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
��1��0��50s�ڵ�ƽ����Ӧ���� v��N2��= ��
��2��250sʱ��H2��ת����Ϊ
��3����֪N��N�ļ���Ϊ946kJ/mol��H��H�ļ���Ϊ436kJ/mol��N��H�ļ���Ϊ391kJ/mol��������1molNH3�����е������仯kJ����ͼ����ȷ��ʾ�÷�Ӧ�������仯���� �� 
��4��Ϊ�ӿ췴Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ a�������¶� b������ѹǿ c������ʱ����He��d����ѹʱ����He�� e����ʱ����NH3
��5������˵��������� a��ʹ�ô�����Ϊ�˼ӿ췴Ӧ���ʣ��������Ч��
b�����������£�N2������100%ת��ΪNH3
c��Ϊ�����N2��ת���ʣ�Ӧ�ʵ����H2��Ũ��
d��250��350s������Ũ�ȱ��ֲ��䣬��Ӧֹͣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����ȡ����Ӧ���ǣ�������
A.����ϩ��ȡ������
B.�����ڹ�������������Ӧ
C.����H2��Ӧ
D.�Ҵ���O2��ȡ��ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���Ȼ���(SnCl4) ʵ���ҿ������ڵ���(�۵�Ϊ23.9��)��Cl2��Ӧ�Ʊ�SnCl4��װ������ͼ��ʾ�ش�����������

��֪SnCl4��ʪ�����м���ˮ������SnO2��xH2O��
���� | ��ɫ��״̬ | �۵�/�� | �е�/�� |
SnCl2 | ��ɫ���� | 246 | 652 |
SnCl4 | ��ɫҺ�� | -33 | 114 |
��1��a�ܵ�������________��װ��A�з�����Ӧ�Ļ�ѧ����ʽ��______________��
��2��װ��B��C��F��G��ʢ�ŵ�����Լ�����Ϊ____________(����ţ��Լ����ظ�ʹ��)��
�ٱ���Na2CO3��Һ ��NaOH��Һ ��ŨH2SO4 ������NaCl��Һ ��H2O
��3����ȼ�ƾ���ǰ��Ҫ���е�һ��������______________��
��4������ȥװ��C����װ��D�п��ܻᷢ������Ҫ����Ӧ�Ļ�ѧ����ʽΪ___________��
��5���õ��IJ����г�����SnCl2��ijʵ��С���õ��������ζ�������Ʒ��SnCl4�ĺ���(Sn2++I2=Sn4++2I-)��ȷ��ȡmg��Ʒ����ƿ�У�������Ũ�����ܽ⣬�ټ�ˮϡ�ͣ�������Һ��ָʾ������0.1mol/L�����Һ�ζ����յ㣬�ﵽ�ζ��յ�ʱ������Ϊ________�����ĵ����Һ20.00mL�������Ʒ��SnCl4�ĺ���______(�ú�m�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ����ͭ��һ����Ҫ�Ļ�ѧ�Լ�����ҵ���õ�Ʒλ�ֿ�(��CuS��Cu2S��CuO���Լ�FeO��Fe2O3��SiO2������)�Ʊ���ˮ����ͭ����������ͼ��ʾ:
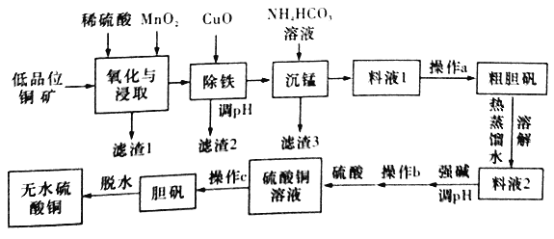
(NH4)2SO4��CuSO4���ܽ��(g)�����������±���ʾ��
�¶� | 10�� | 20�� | 30�� | 40�� | 50�� | 60�� | 100�� |
S(CuSO4)/g | 17 | 20.7 | 24.4 | 28.5 | 33.6 | 40 | 77 |
S[(NH4)SO4]/g | 73 | 75.4 | 78.1 | 81.0 | 84.5 | 87.8 | 102 |
��1���������ȡ�����з����ķ�Ӧ֮һΪCu2S��MnO2����ʱ��һ�ַ�ȫ��������������÷�Ӧ�����ӷ���ʽΪ____________������1����Ҫ�ɷ���__________(�ѧʽ)������ʱ����CuO�ܵõ�����2��ԭ����__________________��
��2��������Ϊ���ж���Һ���Ƿ���Fe3+�����������ʵ�鷽����__________��
��3������ʱ����һ�������������ɣ������ʱ������Ӧ�����ӷ���ʽΪ___________��(��֪pH=8.8ʱ��Mn2+��ʼ����)��
��4��Ϊ�˴���Һ1�о����ܶ�������ֵ���������a��������__________(������)��
��5����ҵ����������ԭ���Ʊ���������֪:298Kʱ��Ksp[Cu(OH)2]=2.2��10-20��Ksp[Fe(OH)3]=8.0��10-38������Ũ��С��1��10-5mol/Lʱ��������������ȫ����������������ij��Һ��c(Cu2+)=2.2 mol/L��c(Fe3+)=O.001mol/L����������ͭ����ʱ��������ҺpH��ΧΪ________(lg5=0.7)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ǰ�����ڵ�5��Ԫ�صIJ�����Ϣ���±���ʾ��
Ԫ�ش��� | Ԫ�ز�����Ϣ |
X | X�������Ӻ�������ƾ������� |
Y | ԭ�ӵ��ܼ�����3��δ�ɶԵ��ӣ��������̬�⻯����ˮ�е��ܽ����ͬ��Ԫ�����γɵ������̬�⻯������� |
Z | ��̬ԭ�ں�����3���ܼ�����˵��ӣ���������ܼ��ĵ���������ǰ�����ܼ��ĵ�����֮�� |
R | Ԫ��ԭ�ڵ�Χ�����Ų�ʽΪnsn-1npn-1 |
T | һ�ֺ��ص�������Ϊ65��������Ϊ36 |
��������Ԫ����Ϣ���ش���������:
��1����̬T2+�ĵ����Ų�ʽΪ____________��
��2��Y.Z.R �ĵ縺���ɴ�С��˳��Ϊ____________ (��Ԫ�ط��ű�ʾ)��
��3��YX4+�Ŀռ乹��Ϊ____________��������Yԭ�ӵ��ӻ��������Ϊ____________ ��YX4+����ʽΪ________��
��4��YX3��һ�ֵȵ����������______��YX3 �ļ��Ǵ���X2Z�ļ��ǵ���Ҫԭ����________��
��5��T���ʲ�����YX3��Һ��Ҳ������X2Z��Һ�������������ǵĻ����Һ������Ҫԭ�����γ����ȶ���[T(YX3)4]2+��1mol���������й�����______mol ������
��6��Z��T��ɵľ����ṹ����ͼ��ʾ����֪Z��Tԭ�ӵİ뾶�ֱ�Ϊapm��bpm�������߳�Ϊcpm����þ�����ԭ�ӵĿռ�������Ϊ________(�ô���ʽ��ʾ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д�ʩ������Ӧ����������Ч���ǣ� ��
A.Na��ˮ��Ӧʱ����ˮ������
B.Fe��ϡ���ᷴӦ��ȡ����ʱ������Ũ����
C.��K2SO4��BaCl2����Һ��Ӧʱ�����������Ȼ��ƹ���
D.����Ƭ��Ϊ���ۣ�������������Ӧ��ʵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�Al��OH��3����ã�������
A.Al2O3��ϡ����
B.Al2O3��ˮ
C.Al2��SO4��3��KOH
D.AlCl3�Ͱ�ˮ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com