
【题目】工业合成氨的反应如下:N2(g)+3H2(g)2NG3(g). 某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2 , 一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50s内的平均反应速率 v(N2)= .
(2)250s时,H2的转化率为
(3)已知N≡N的键能为946kJ/mol,H﹣H的键能为436kJ/mol,N﹣H的键能为391kJ/mol,则生成1molNH3过程中的热量变化kJ.下图能正确表示该反应中能量变化的是 . 
(4)为加快反应速率,可以采取的措施 a.降低温度 b.增大压强 c.恒容时充入He气d.恒压时充入He气 e.及时分离NH3
(5)下列说法错误的是 a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.为了提高N2的转化率,应适当提高H2的浓度
d.250~350s生成物浓度保持不变,反应停止.
【答案】
(1)1.2×10﹣3mol/(L?s)
(2)30%
(3)92;A
(4)b
(5)d
【解析】解:(1)图表中0~50s内氨气的浓度变化为0.24mol,计算氨气的反应速率v(NH3)= ![]() =0.0024mol/(Ls),v(NH3):v(N2)=2:1,v(N2)=
=0.0024mol/(Ls),v(NH3):v(N2)=2:1,v(N2)= ![]() =1.2×10﹣3mol/(Ls ), 所以答案是:1.2×10﹣3mol/(Ls );(2)250s时,氨气生成的物质的量为0.40mol,则反应的氢气物质的量=0.6mol,转化率=
=1.2×10﹣3mol/(Ls ), 所以答案是:1.2×10﹣3mol/(Ls );(2)250s时,氨气生成的物质的量为0.40mol,则反应的氢气物质的量=0.6mol,转化率= ![]() ×100%=
×100%= ![]() ×100%=30%,
×100%=30%,
所以答案是:30%;(3)已知N≡N的键能为946kJ/mol,H﹣H的键能为436kJ/mol,N﹣H的键能为391kJ/mol,N2(g)+3H2(g)2NH3(g),生成1molNH3反应过程中能量变化= ![]() ×946KJ/moL+
×946KJ/moL+ ![]() ×436KJ/mol﹣3×391kJ/mol=﹣92KJ/mol,则生成1molNH3过程中的热量变化位92KJ,反应为放热反应,反应物能量高于生成物的能量,反应为放热反应,正确表示该反应中能量变化的是选A,
×436KJ/mol﹣3×391kJ/mol=﹣92KJ/mol,则生成1molNH3过程中的热量变化位92KJ,反应为放热反应,反应物能量高于生成物的能量,反应为放热反应,正确表示该反应中能量变化的是选A,
所以答案是:92;A;(4)a.降低温度,反应速率减小,故a错误;
b.增大压强,反应速率增大,故b正确;
c.恒容时充入He气,总压增大,分压不变,平衡不变,反应速率不变,故c错误;
d.恒压时充入He气,体积增大,压强减小,反应速率减小,故d错误;
e.及时分离NH3 反应正向进行,难度减小反应速率减小,故e错误;
所以答案是:b;
·(5)a.使用催化剂是为了加快反应速率,缩短了反应达到平衡的时间,提高了生产效率,故a正确;
b.上述条件下,反应为可逆反应,N2不可能100%转化为NH3 , 故b正确;
c.为了提高N2的转化率,应适当提高H2的浓度,提高氮气的转化率,氢气转化率减小,故c正确;
d.250~350s生成物浓度保持不变,反应达到平衡状态,反应仍然进行.只是正逆反应速率相同,故d错误;
所以答案是:d.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有一种有机物 ![]() ,则对该有机物的说法正确的是( )
,则对该有机物的说法正确的是( )
A.能使溴水、酸性高锰酸钾溶液褪色
B.分子中所有原子在同一平面内
C.分子式为C9H12O
D.能发生加成反应、酯化反应、水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于非氧化还原反应,又是放热反应的是( )
A.锌粒与稀硫酸的反应
B.酸碱中和反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)①为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:适当升高温度,搅拌,______等。
②酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。在沉镍前,需加Na2CO3控制溶液pH范围为______。
(2)“氧化”生成Ni2O3的离子方程式为______。
(3)工业上用镍为阳极,电解0.05 ~ 0.1 mol·L-1 NiCl2 溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如下图所示,则NH4Cl的浓度最好控制为______。

II、煤制天然气的工艺流程简图如下:

(4)已知反应I:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
(5)①甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_____。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是____。
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应:CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的
2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的![]() H=______。
H=______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)为了探究Cl2、SO2同时通入H2O发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
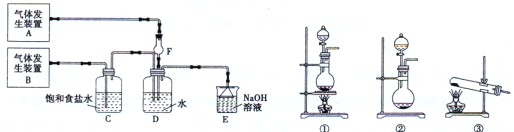
试填空:
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是 ;气体发生装置B应选择①、②、③三种装置中的 (选填序号)。
(2)D装置中主要反应的离子方程式为: 。
(3)为验证通入D装置中气体是Cl2过量还是SO2过量,兴趣小组的同!学准备了以下试剂:氯化铁溶液;氯化亚铁溶液;硫氰化钾溶液;苯酚溶液;品红溶液;酸性高锰酸钾溶液。
若Cl2量:取适量D中溶液滴加至盛有 (试剂名称,下同)的试管中,再加入产生的现象是 ,说明Cl2过量;
若SO2过量:取适量D中溶液滴加至盛有 的试管内,产生的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制6.0mol/L的H2SO4溶液1000mL,实验室有三种不同浓度的硫酸:①480mL0.5mol/L的硫酸;②150mL25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L (保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为 mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部注入烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸 mL,注入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D. ;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响? (填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: 
(1)连接上述仪器的正确顺序是:E接 , 接 , 接 , 接F.
(2)气体发生装置中进行的反应化学方程式是;当0.5mol MnO2参与反应时,被氧化的HCl的质量为 , 生成的Cl2在标准状况下的体积约为 .
(3)在装置中:①饱和食盐水的作用是 , ②浓硫酸的作用是 .
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉﹣KI试纸.如果有Cl2产生,可观察到的现象是 , 写出反应方程式 .
(5)写出尾气吸收装置中进行的反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com