
【题目】在实验室中,下列除去杂质的方法正确的是
A.溴苯中混有溴,加入KI溶液,振荡,再用汽油萃取
B.硝基苯中混有浓硝酸和浓硫酸,将其倒入到NaOH溶液中,静置,分液
C.乙烷中混有乙烯,通氢气在一定条件下反应,使乙烯转化为乙烷
D.乙烯中混有SO2和CO2,将其先后通入NaOH和KMnO4溶液中洗气
科目:高中化学 来源: 题型:
【题目】在测定中和反应反应热的实验中,下列叙述错误的是
A. 向小烧杯中加入盐酸,测量的温度为盐酸的起始温度
B. 实验中可使酸或碱略过量
C. 向小烧杯中加碱液时,碱液的温度应与酸的温度相同
D. 可以用氢氧化钾代替氢氧化钠,浓硫酸代替盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-266 kJ·mol-1
O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 右图可表示由CO生成CO2的反应过程和能量关系
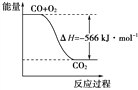
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH > -532 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家曾在英国《自然》杂志上报道,他们用DNA制造出一种臂长7 nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中的分散质的微粒直径和上述镊子的臂长具有相同数量级的是( )
A. 溶液 B. 悬浊液
C. 胶体 D. 乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E等几种烃分子的球棍模型如图所示,据此回答下列问题. 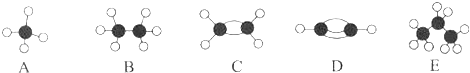
(1)D的化学式为 , A的二氯取代物有种.
(2)可作为植物生长调节剂的是(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,甲中盛有100mL 0.1mol/LCuSO4溶液,乙中盛有100mL 0.2mol/L Na2SO4溶液。
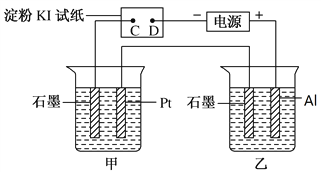
(1)通电一段时间,观察到湿润的淀粉KI试纸的_____(选填“C”或“D”)端变蓝。
(2)装置乙中观察到的现象是_________________________________________。
(3)若电解一段时间后,装置甲、乙中共收集到气体0.168 L(标准状况下),则:
①装置甲中发生反应的离子反应方程式为______________________________。
②若电解前后体积变化忽略不计,则电后装置甲中溶液的c(H+)为________。
(4)若电解一段时间后,装置甲中溶液需加入0.005mol碱式碳酸铜才能恢复原来的浓度和pH,则电解过程中转移的电子数目为__________。
(5)若装置中的电源使用如右图的一种新型燃料电池,以甲醇为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,则负极反应式为__________________。
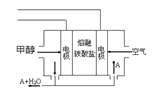
(6)电解一段时间后,拆解装置,将图中甲装置取出后,用导线将石墨和Pt连接构成闭合回路。则此装置中Pt上发生的电极反应式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断开1mol H一H键、1mol N一H键、1mol N≡N 键分别需要吸收能量为436kJ、391kJ、946kJ,求:H2与N2反应生成0.5molNH3填 (“吸收”或“放出”)能量 kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用基团间相互作用来解释的是
A.与Na反应时,乙醇的反应速率比水慢
B.苯酚能与NaOH溶液反应而乙醇不能
C.乙醇能使重铬酸钾溶液褪色而乙酸不能
D.苯、甲苯发生硝化反应生成一硝基取代产物时,甲苯的反应温度更低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料,还可以作为燃料电池的原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1 (已知:CO的结构与N2相似)
CH3OH(g) ΔH1 (已知:CO的结构与N2相似)
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C=O | H-O | C-H |
E/(KJ/mol) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=_____kJ·mol-1。
(2)已知:
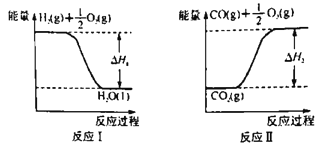
若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g) ![]() CH3OH(l)的ΔH=________。若ΔH1=-285.8 kJ·mol-1,ΔH2=+283.0 kJ·mol-1,某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为______。
CH3OH(l)的ΔH=________。若ΔH1=-285.8 kJ·mol-1,ΔH2=+283.0 kJ·mol-1,某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为______。
(3)以CH4和H2O为原料,通过下列反应也可以制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)= =CH3OH (g)ΔH=-129.0 kJ·mol-1
CH4(g)+H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com