
| A、32gO3所含有的原子数目与1molO2所含原子物质的量相等 |
| B、4g金属钙变成钙离子时失去的电子数目为0.1NA |
| C、1molCH3+所含的电子数为10NA |
| D、标准状况下,22.4L H2O所含的分子数为NA |
| 32g |
| 48g/mol |


科目:高中化学 来源: 题型:
| A、碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
B、由于乳酸(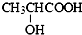 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 |
| C、HF的稳定性很强,是因为其分子间能形成氢键 |
D、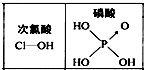 由图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、因为酸性:HCl>H2CO3,所以非金属性:Cl>C |
| B、第ⅦA元素从上到下,其氢化物的稳定性逐渐增强 |
| C、同周期第ⅡA族与第IIIA族的元素原子序数之差不一定为1 |
| D、同周期主族元素的原子形成的简单离子电子层结构相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com