
下面的排序不正确的是
A.熔点由低到高:CH4<SiH4<GeH4<SnH4
B.熔点由高到低:Rb>K>Na
C.硬度由大到小:金刚石>碳化硅>晶体硅
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
B
【解析】
试题分析:A、碳族元素的氢化物都是分子晶体,熔点随相对分子质量的增大而升高,正确;B、碱金属是金属晶体,随核电荷数的增大,熔点逐渐降低,错误;C、金刚石、硅、碳化硅都是原子晶体,硬度的大小与共价键的强弱有关,原子半径小,共价键越强,所以半径由小到大:金刚石>碳化硅>晶体硅,则硬度由大到小:金刚石>碳化硅>晶体硅,正确;D、离子晶体中的晶格能与离子半径、离子的电荷数有关,离子半径越小、所带电荷越多,离子键越强,晶格能越大,卤化钠的阳离子相同,阴离子的半径随F、Cl、Br、I逐渐增大,所以晶格能由大到小:NaF>NaCl>NaBr>NaI,正确,答案选B。
考点:考查物质的熔点、硬度、晶格能的比较


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:2014-2015学年天津市和平区高一上学期期中化学试卷(解析版) 题型:填空题
(12分)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg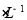 。现用氯氧化法处理,发生如下反应(其中N均为一3价、O均为-2价):
。现用氯氧化法处理,发生如下反应(其中N均为一3价、O均为-2价):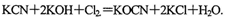 该反应中,被氧化的元素是___________.
该反应中,被氧化的元素是___________.
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移方向和数目: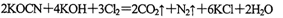
(3)若处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯___________g.
(4)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是___________.
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中—种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:________.(已知:氯元素最高化合价为+7价)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列微粒中存在配位键的是
①H3O+②[Cu(NH3)4]2+③CH3COO-④H2S⑤CH4
A.①② B.①③ C.④⑤ D.②④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列选项正确的是
A.向FeBr2溶液中通入少量的氯气:Cl2+2Br-=2Cl-+Br2
B.大理石溶于醋酸:CaCO3+2H+=Ca2+ +CO2↑+H2O
C.使石蕊呈蓝色的溶液中,可能存在大量的:Na+、AlO2-、NO3-、HCO3-
D.加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:填空题
(12分)根据已学知识,请你回答下列问题:
(1)试比较含氧酸的酸性强弱(填“>”、“<”或“=”): HClO3_____HClO4。
(2)根据价层电子对互斥理论判断:H2O的VSEPR构型为 H3O+ 的分子立体结构为 。
(3)沸点比较:邻羟基苯甲醛 对羟基苯甲醛(填“>”、“<”或“=”)
(4)在下列物质①NH3、②BF3、③HCl、④SO3,属于非极性分子的是(填番号)________。
(5)①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有 (填序号)。
(6)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
(7)配离子[TiCl(H2O)5]2+的中心离子的符号为 ,配位数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
下列物质的类别与所含官能团都正确的是
A.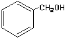 酚类 –OH
酚类 –OH
B.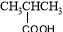 羧酸 –CHO
羧酸 –CHO
C.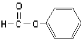 醛类 –CHO
醛类 –CHO
D.CH3-O-CH3 醚类 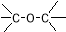
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
下列晶体中,化学键类型相同,晶体类型也相同的是
A.SO2与SiO2 B.CO2与H2O C.NaCl与HCl D.CCl4与KCl
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一10月月考化学试卷(解析版) 题型:选择题
某同学用Na2CO3配制0.10 mol/L Na2CO3溶液的过程如图所示。你认为该同学的错误有
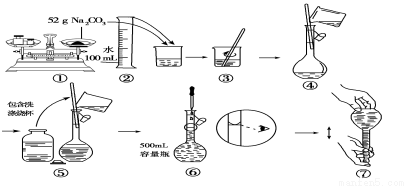
A.①⑤⑥ B.②④⑦ C.①⑥ D.⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:填空题
(14分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
|
| |||||||||||||||
A | B |
|
| C | D |
|
|
| |||||||||
E | F | G |
|
| H | I |
| ||||||||||
|
|
|
|
| J |
|
|
|
| K |
|
|
|
|
| M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)写出基态时J的电子排布式 ,L的原子序数为 ,M的简化电子排布式 。
(2)下列关于元素在元素周期表中的位置的叙述正确的是 。
A.K位于元素周期表中第四周期、ⅡB族,属于ds区元素;
B.J位于元素周期表中第四周期、ⅣB族,属于d区元素;
C.F位于元素周期表中第三周期、ⅡA族,属于s区元素;
D.I位于元素周期表中第三周期、ⅦA族,属于ds区元素;
(3)下列有关说法正确的是 。
A.第一电离能G>F>E; B.电负性D>C;
C.原子半径E>B D.最高价含氧酸的酸性I>H
(4)根据对角线规则及已知元素性质,回答下列问题:
①B元素最高价氧化物的水化物与E元素最高价氧化物的水化物的溶液反应的离子方程
式 。
②A元素的单质与氧气在点燃时的化学反应方程式 。
(5)下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
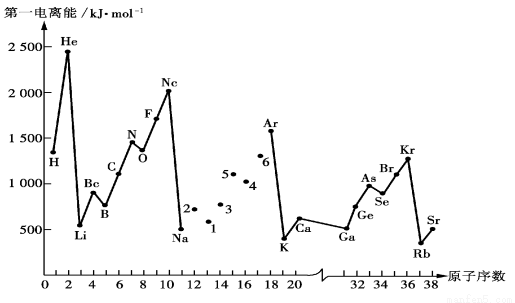
① 认真分析下图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
② 从下图分析可知,同一主族元素原子的第一电离能I1变化规律是
___________________________________________________________________________;
Zn的第一电离能大于Ga的原因是
。
③上图中5号元素在周期表中的位置是____________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com