
(14分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
|
| |||||||||||||||
A | B |
|
| C | D |
|
|
| |||||||||
E | F | G |
|
| H | I |
| ||||||||||
|
|
|
|
| J |
|
|
|
| K |
|
|
|
|
| M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)写出基态时J的电子排布式 ,L的原子序数为 ,M的简化电子排布式 。
(2)下列关于元素在元素周期表中的位置的叙述正确的是 。
A.K位于元素周期表中第四周期、ⅡB族,属于ds区元素;
B.J位于元素周期表中第四周期、ⅣB族,属于d区元素;
C.F位于元素周期表中第三周期、ⅡA族,属于s区元素;
D.I位于元素周期表中第三周期、ⅦA族,属于ds区元素;
(3)下列有关说法正确的是 。
A.第一电离能G>F>E; B.电负性D>C;
C.原子半径E>B D.最高价含氧酸的酸性I>H
(4)根据对角线规则及已知元素性质,回答下列问题:
①B元素最高价氧化物的水化物与E元素最高价氧化物的水化物的溶液反应的离子方程
式 。
②A元素的单质与氧气在点燃时的化学反应方程式 。
(5)下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
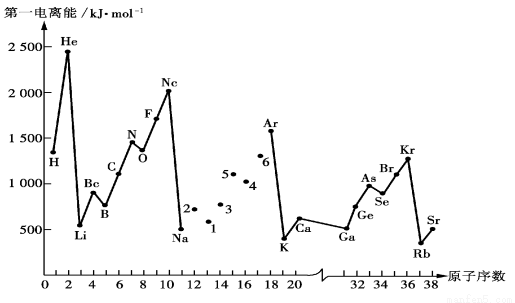
① 认真分析下图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
② 从下图分析可知,同一主族元素原子的第一电离能I1变化规律是
___________________________________________________________________________;
Zn的第一电离能大于Ga的原因是
。
③上图中5号元素在周期表中的位置是____________________________;
(14分)
(1)1s22s22p63s23p63d54s1 56
[Ar]3d104s24p5
(2)C
(3)BCD (2分)
(4)Be(OH)2+2OH-=BeO22-+2H2O (2分) 4Li+O2 2Li2O
2Li2O
(5) ① 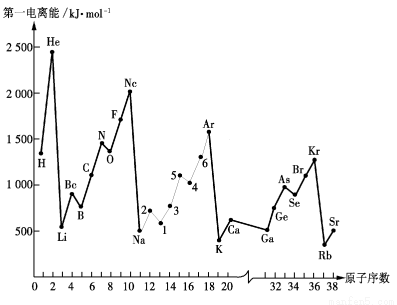 ②从上到下依次减小;
②从上到下依次减小;
Zn的外围电子排布式为3d104s2,是全充满稳定结构;而Ga的外围电子排布式为4s24p1,失去一个电子才是全充满稳定结构,所以Zn的第一电离能更高(2分)
③第三周期ⅤA族;
【解析】
试题分析:(1)J是Cr元素,M层的3d能级上排5个电子为半充满状态,最外层只有1个电子,所以核外电子排布式为1s22s22p63s23p63d54s1;L是Ba元素,原子序数是56,;M是Br元素,是第四周期第七主族元素,所以简化的电子排布式为[Ar]3d104s24p5
(2)A、K属于IB元素,属于ds区元素,错误;B、J是VIB元素,属于d区元素,错误;C、F是元素周期表中第三周期、ⅡA族,属于s区元素,正确;D、I是第三周期、第VIIA族元素,是P区元素,错误,答案选C。
(3)A、同周期元素,从左到右,元素的第一电离能逐渐增大,而F的3s能级是全充满状态,属于稳定结构,所以第一电离能的大小顺序是F>G>E,错误;B、同周期中,随原子序数的增大,元素的电负性逐渐增大,所以电负性D>C,正确;C、E比B多一个电子层,所以E的原子半径大于B,正确;D、I的非金属性比H强,所以I的最高价含氧酸的酸性比H强,正确,答案选BCD;
(4)B与G是对角线关系,G是Al元素,所以Be的最高价氧化物的水化物与氢氧化铝的化学性质相似,能与氢氧化钠溶液反应,离子方程式为Be(OH)2+2OH-=BeO22-+2H2O;
Li在氧气中燃烧生成的产物也只是氧化锂,化学方程式为4Li+O2 2Li2O;
2Li2O;
(5) ①在第三周期元素中,由于Mg的最外层是全充满结构,P的3p能级是半充满结构,所以第一电离能比后面的元素高,如图:
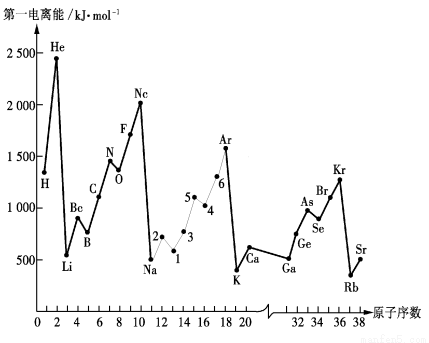
②从下图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下逐渐减小;
Zn的第一电离能大于Ga的原因是Zn的外围电子排布式为3d104s2,是全充满稳定结构;而Ga的外围电子排布式为4s24p1,失去一个电子才是全充满稳定结构,所以Zn的第一电离能更高;
③5号是P元素,位于元素周期表中的第三周期第VA族。
考点:考查元素周期表、核外电子排布式的书写、第一电离能的判断,电负性的判断,对角线关系的应用


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
下面的排序不正确的是
A.熔点由低到高:CH4<SiH4<GeH4<SnH4
B.熔点由高到低:Rb>K>Na
C.硬度由大到小:金刚石>碳化硅>晶体硅
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
向KI溶液中加入AgNO3溶液,直到恰好完全反应,反应后溶液的质量恰好等于原KI溶液的质量,则原AgNO3溶液的质量分数为
A、72.3% B、50% C、48.3% D、38%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
已知大多数含氧酸可用通式XOm(OH)n来表示,如X是S,则m =2,n =2,则这个式子就表示H2SO4。一般而言,该式中m大于等于2的是强酸,m为0的是弱酸。下列各含氧酸中酸性最强的是
A.H2SeO3 B.HMnO4 C.H3BO3 D.H3PO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
下列是几种原子的基态电子排布,电负性最大的原子是
A.1s22s22p4 B.1s22s22p63s23p3
C.1s22s22p63s23p2 D.1s22s22p63s23p64s2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:选择题
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外电子层电子数之比为4︰3,Z原子比X原子的核外电子数多4。下列说法正确的是
A. W、Y、Z的电负性大小顺序一定是Z>Y>W
B. W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C. Y、Z形成的分子的空间构型可能是正四面体
D. WY2分子中σ键与π键的数目之比是2︰1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:选择题
用R代表短周期元素,R原子最外层的p能级上的未成对电子只有2个。下列关于R的描述中正确的是
A.R的氧化物都能溶于水
B.R都是非金属元素
C.R的氧化物都能与NaOH反应
D.R的最高价氧化物对应的水化物都是H2RO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市新高三起点调研考试化学试卷(解析版) 题型:选择题
常温下,下列各溶液的叙述中正确的是
A.NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-)
B.0.1 mol/L的醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后溶液显酸性:
c(CH3COO-)>c(CH3COOH) >c(Cl-)>c(H+)
C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D.向1.00 L 0.3 mol/L NaOH溶液中缓慢通入0.2 mol CO2气体,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春外国语学校高一上学期期中化学试卷(解析版) 题型:填空题
在Fe、Fe3+、Fe2+几种微粒中,只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。向黄色的FeCl3溶液中加入 铁粉,溶液颜色变为浅绿色,写出该反应的离子方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com