
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq)△H1=akJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=bkJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=ckJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=_____kJ·mol-1。
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是_______。

⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数K=____。[已知Ksp(CaCO3)=2.9×10-9,Ksp(CaSO4)=9.1×10-6]
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为________。

②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:_____________。
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:___________。
【答案】 2a+2b+c 温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低) 3138 2Cu2S+2(NH4)2SO4+5O2![]() 4CuSO4+4NH3+2H2O
4CuSO4+4NH3+2H2O ![]() 配制较高温度(80℃-100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤
配制较高温度(80℃-100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤
【解析】(1)已知:①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=akJ·mol-1 ②NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=bkJ·mol-1 ③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=ckJ·mol-1 ,根据盖斯定律:①×2+②×2+③得反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=(2a+2b+c)kJ·mol-1;
(2) (NH4)2SO3受热易分解,(NH4)2SO3为弱酸弱碱盐,水解吸热,气体的溶解度随温度升高而减小,故当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中的溶解度降低);
(3)反应:CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s)的平衡常数![]() ;
;
(4)①Cu2S与硫酸铵混合后在空气中进行焙烧生成硫酸铜和氨气,利用化合价升降法配平,该反应的化学方程式为2Cu2S+2(NH4)2SO4+5O2![]() 4CuSO4+4NH3+2H2O;②分析图甲可知0.4mol硫酸铵在500℃下分解,反应进行到60min时,消耗0.3mol硫酸铵,生成0.4mol氨气和0.1mol氮气,即3mol硫酸铵分解生成4mol氨气和1mol氮气,氮元素的化合价由硫酸氨中的-3价升高到氮气的0价,失去6mol电子,根据电子守恒推出3mol硫酸根中硫元素的化合价由+6价降低为+4价,生成3mol二氧化硫,结合原子守恒推断另一种产物为水;③根据图乙可知相同温度下溶解度:硫酸铵>氯化钾>硫酸钾,则由(NH4)2SO4、KCl为原料制备K2SO4的实验方案为配制较高温度(80℃-100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶、过滤、洗涤。
4CuSO4+4NH3+2H2O;②分析图甲可知0.4mol硫酸铵在500℃下分解,反应进行到60min时,消耗0.3mol硫酸铵,生成0.4mol氨气和0.1mol氮气,即3mol硫酸铵分解生成4mol氨气和1mol氮气,氮元素的化合价由硫酸氨中的-3价升高到氮气的0价,失去6mol电子,根据电子守恒推出3mol硫酸根中硫元素的化合价由+6价降低为+4价,生成3mol二氧化硫,结合原子守恒推断另一种产物为水;③根据图乙可知相同温度下溶解度:硫酸铵>氯化钾>硫酸钾,则由(NH4)2SO4、KCl为原料制备K2SO4的实验方案为配制较高温度(80℃-100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶、过滤、洗涤。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是

A. 简单离子半径:Z<Y
B. 阴离子的还原性:Y>W
C. 简单气态氢化物的热稳定性:Y>X
D. W2Y2 中含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系说法正确的是( )
A.胶体与溶液本质区别是有无丁达尔效应
B.均一稳定的分散系只有溶液
C.只有胶状物质如胶水、果冻才能称为胶体
D.一束平行光线照射Fe(OH)3胶体时,从侧面可以看到一条光亮通路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是人类获取能量的重要途径。
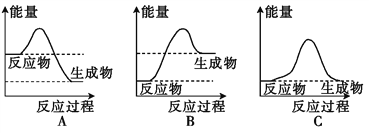
(1)液化气是一种重要的家用燃料,下列示意图与液化气在燃烧过程中的能量 变化最相符的是___________(填字母)。
(2)“冰袋”可用于短时间保鲜食物。将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温。由此判断:反应后生成产物的总能量_______(填“高于”或“低于”)碳酸钠晶体与硝酸铵晶体的总能量。
(3)化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化。比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为光能和________;人们普遍使用的干电池工作时是将化学能转化为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体。由此他提出必须先除去杂质,再与溴水反应。请回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式:____________________。
(2)甲同学设计的实验________(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是________。
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是___________,它与溴水反应的化学方程式是___________________,在验证过程中必须全部除去。
(4)请你选用下列四个装置(见下图,可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
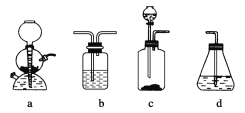
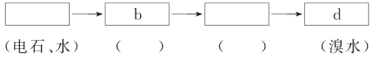
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性。理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块铝箔,用砂纸打磨表面后,在酒精灯上加入熔化,下列说法正确的是
A. 铝箔燃烧 B. 熔化的是Al2O3 C. 熔化物滴落 D. 熔化物不滴落
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光纤通信70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光学纤维是由下列哪种物质经特殊工艺制成的
A. 碳 B. 二氧化硅 C. 锗 D. 硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com