
【题目】短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是

A. 简单离子半径:Z<Y
B. 阴离子的还原性:Y>W
C. 简单气态氢化物的热稳定性:Y>X
D. W2Y2 中含有非极性键
【答案】B
【解析】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,d为Na2O2,结合图中转化可知,m为元素Y的单质,通常为无色无味的气体m为O2,则Y为O,a为烃,b、c分别为CO2、H2O,e、f分别为NaOH、碳酸钠,结合原子序数可知,W为H,X为C,Y为O,Z为Na。A.Z、Y的离子具有相同电子层结构,原子序数大的离子半径小,则简单离子半径:Z<Y,故A正确;B.由NaH+H2O=NaOH+H2↑,可知H-失去电子,阴离子的还原性:Y<W,故B错误;C.非金属性越强,对应氢化物越稳定,则简单气态氢化物的热稳定性:Y>X,故C正确;D.H2O2中含有O-O非极性键,故D正确;故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述的说法不正确的是
A.金属的电化学腐蚀比化学腐蚀更普遍
B.用牺牲锌块的方法来保护船身
C.用铝质铆钉铆接铁板,铁板易被腐蚀
D.在镀件上电镀锌,用锌作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗语“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是
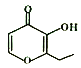
A. 该机物能与Na、NaOH发生反应
B. 1mol该有机物最多能与2molH2发生加成反应
C. 该机物能发生取代、加成、氧化和还原反应
D. 该机物的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.lmol·L-1的三种酸HA、HB和HD溶液,pH随NaOH溶液体积变化如图。下列说法不正确的是( )
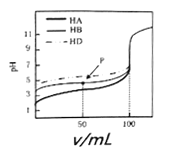
A. HA、HB和HD均为弱酸
B. P点时,c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 三种酸溶液分别被NaOH溶液恰好完全中和后互混:c(HA)+c(HB)+c(HD)=c(OH-) - c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语
回答下列问题:
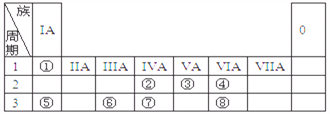
(1)画出⑦的原子结构示意图_______;
(2)②⑤⑥的原子半径由大到小的顺序为_______(填元素符号);②⑦⑧的最高价含氧酸的酸性由强到弱的顺序是_______(填化学式);
(3)②与④的一种化合物是温室气体的主要成分,该物质的结构式为_____________;
(4)①③④⑧四种元素形成的一种化合物既含离子键又含共价键,还可以用作化肥,
该物质的化学式为___________。
(5)⑤⑥⑧的最高价氧化物的水化物之间可以相互反应,请写出⑤⑥两元素最高价氧化物的水化物之间发生反应的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代化学成绩斐然,下列说法错误的是
A. 古代造纸是以木材等为原料,用去除杂质后的纤维素制成的,纤维素属子天然高分子
B. 火药是由硫磺、木炭、硝酸钾按照一定比例混合制得的
C. “China”来源于闻名于世的我国陶瓷,陶瓷是一种硅酸盐产品
D. 司母戊鼎是商朝铸造的青铜器,它是由纯铜制作的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq)△H1=akJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=bkJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=ckJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=_____kJ·mol-1。
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是_______。

⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数K=____。[已知Ksp(CaCO3)=2.9×10-9,Ksp(CaSO4)=9.1×10-6]
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为________。

②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:_____________。
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·molˉ1,下列说法不正确的是
A.CO(g)+![]() O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
B.2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C.相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D.拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com