
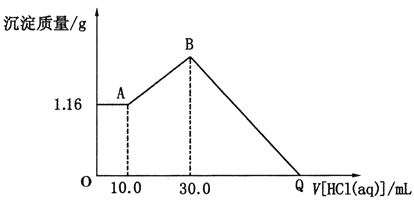
【题目】将NaOH、MgCl2、A1C13三种固体组成的混合物溶于足量水后得1.16g白色沉淀。在所得的浊液中逐滴加入1mo1·L-1HC1溶液,加入HC1溶液的体积与生成沉淀的质量关系如图所示,试回答:
(1)写出混合物溶于水时发生反应的离子方程式:_____________________________。
(2)写出AB段反应的离子方程式:_______________________________。
(3)原混合物中NaOH的物质的量是多少?(写出计算过程) ___________。
【答案】Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O AlO2-+H++H2O=Al(OH)3↓ AB段消耗n(HCl)=1mol/L×(0.03L-0.01L)=0.02mol,根据Al守恒和离子反应AlO2-+H++H2O=Al(OH)3↓,n(AlCl3)=n(AlO2-)=n[Al(OH)3]=0.02mol,根据反应Al3++4OH-=AlO2-+2H2O,与AlCl3反应的NaOH物质的量为0.08mol;由镁元素的质量守恒可得n(MgCl2)=n[Mg(OH)2]=![]() =0.02mol,根据反应Mg2++2OH-=Mg(OH)2↓,与MgCl2反应的NaOH物质的量为0.04mol;与HCl反应的NaOH物质的量为1mol/L×0.01L=0.01mol;原混合物中NaOH物质的量为0.08mol+0.04mol+0.01mol=0.13mol。
=0.02mol,根据反应Mg2++2OH-=Mg(OH)2↓,与MgCl2反应的NaOH物质的量为0.04mol;与HCl反应的NaOH物质的量为1mol/L×0.01L=0.01mol;原混合物中NaOH物质的量为0.08mol+0.04mol+0.01mol=0.13mol。
【解析】
开始加入10mLHCl溶液,沉淀的质量既不增加也不减少,说明此时加入的10mL盐酸与NaOH反应,则NaOH、MgCl2、A1C13三种固体组成的混合物溶于足量水后所得1.16g白色沉淀全部为Mg(OH)2,溶液中为过量的NaOH和生成的NaAlO2、NaCl,故在此浊液中加入盐酸时,所发生的反应分为以下三个阶段:
开始到A点:H++OH-=H2O;
AB段:AlO2-+H++H2O=Al(OH)3↓;
BQ段:Mg(OH)2+2H+=Mg2++2H2O、Al(OH)3+3H+=Al3++3H2O,
据以上分析计算解答。
(1)开始加入10mLHCl溶液,沉淀的质量既不增加也不减少,说明此时加入的10mL盐酸与NaOH反应,当NaOH过量时,铝元素全部以AlO2-存在于溶液中,则原固体混合物溶于水后发生的反应有:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,1.16g白色沉淀为Mg(OH)2;原固体混合物溶于水发生反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,故答案为:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O;
(2)在AB段随盐酸的加入,沉淀的量逐渐增多,所在发生的离子反应为:AlO2-+H++H2O=Al(OH)3↓,故答案为:AlO2-+H++H2O=Al(OH)3↓;
(3)AB段消耗n(HCl)=1mol/L![]() (0.03L-0.01L)=0.02mol,根据Al守恒和离子反应AlO2-+H++H2O=Al(OH)3↓,n(AlCl3)=n(AlO2-)=n[Al(OH)3]=0.02mol,根据反应Al3++4OH-=AlO2-+2H2O,与AlCl3反应的NaOH物质的量为0.08mol;由镁元素的质量守恒可得n(MgCl2)=n[Mg(OH)2]=
(0.03L-0.01L)=0.02mol,根据Al守恒和离子反应AlO2-+H++H2O=Al(OH)3↓,n(AlCl3)=n(AlO2-)=n[Al(OH)3]=0.02mol,根据反应Al3++4OH-=AlO2-+2H2O,与AlCl3反应的NaOH物质的量为0.08mol;由镁元素的质量守恒可得n(MgCl2)=n[Mg(OH)2]= ![]() =0.02mol,根据反应Mg2++2OH-=Mg(OH)2↓,与MgCl2反应的NaOH物质的量为0.04mol;与HCl反应的NaOH物质的量为1mol/L
=0.02mol,根据反应Mg2++2OH-=Mg(OH)2↓,与MgCl2反应的NaOH物质的量为0.04mol;与HCl反应的NaOH物质的量为1mol/L![]() 0.01L=0.01mol;原混合物中NaOH物质的量为0.08mol+0.04mol+0.01mol=0.13mol,故答案为:0.13mol。
0.01L=0.01mol;原混合物中NaOH物质的量为0.08mol+0.04mol+0.01mol=0.13mol,故答案为:0.13mol。


科目:高中化学 来源: 题型:
【题目】常温下,某反应体系中存在六种粒子:ClO4-、SO42-、ClO3-、S2O82-、H+、H2O。在反应过程中,溶液的 pH 与反应进程的关系如图所示。下列说法正确的是

A. ClO4-是氧化剂
B. SO42-是氧化产物
C. 氧化性:S2O82->ClO3-
D. 生成 1 mol 还原产物时转移 2 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醛和苯酚为主要原料,经如图所示系列转化可合成酚醛树脂和重要有机合成 中间体 D(部分反应条件和产物略去):
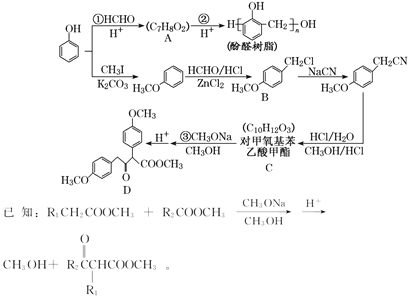
(1)CH3OH 的名称为_____。
(2)C 中所含官能团的名称是_____。
(3)反应②的化学方程式是_____。
(4)下列关于 A 的性质,能反映支链对苯环结构产生影响的是_____(填字母)。
a.能与氢氧化钠溶液反应 b.能使酸性高锰酸钾溶液褪色 c.稀溶液中加浓溴水产生沉淀
(5)E(C8H10O2)与 B 的水解产物互为同分异构体,1 mol E 可与 2 mol NaOH 反应,其核磁共振氢谱显示有 3 种峰且峰面积之比为 3∶1∶1,符合条件的 E 共有_____种。
(6) 完成下面以 CH3OH 和 CH3ONa 为 原 料 ( 其 他 无 机 试 剂 任 选 ) 制 备 化 合 物CH3COCH2COOCH3 的合成路线。 CH3OH――△→… ___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种有机物的结构简式如下图所示,下列说法正确的是

A. 甲和乙均可以和氢氧化钠溶液反应
B. 有机物乙存在顺反异构
C. 乙分子中所有的碳原子一定在同一平面上
D. 甲和乙均能与溴水发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对维持生物体正常生命活动必不可少的微量元素是
A. Fe、Mn、Zn、Mg
B. Zn、Cu、Mn、Ca
C. Mg、Mn、Cu、Mo
D. Zn、Cu、B、Mn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸(α﹣羟基丁二酸)是一种健康食品饮料,结构如图:
![]()
下列相关说法不正确的是
A. 苹果酸在铜或银作催化剂下,能与氧气反应
B. 苹果酸在一定条件下能形成环状有机化合物
C. 苹果酸在氢氧化钠的乙醇溶液中加热,能发生消去反应
D. 苹果酸能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求,回答下列问题。
(1)选择下面的实验装置能完成相应的实验:
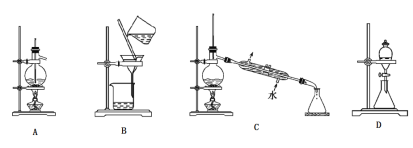
实验室制取乙烯到的装置是_____(填写序号,下同);分离苯和甲苯的装置是_________;提纯苯甲酸过程中进行分离操作用到的装置是_________;用CCl4萃取溴水中的溴用到的装置是_________。
(2)以下是五种常见有机物分子模型示意图,其中A、B、C为烃, D、E为烃的含氧衍生物。

鉴别A和B的试剂为__________;上述物质中有毒、有特殊气味,且不溶于水、密度比水小的液体是__________(填名称);D分子中的官能团是________;鉴别E的试剂可以选用______________。
(3)写出下列化学方程式:
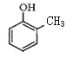 与足量溴水反应_____________________________________________;
与足量溴水反应_____________________________________________;
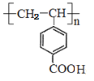 与足量NaOH溶液反应_______________________________。
与足量NaOH溶液反应_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,易水解,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因__________。
(2)已知CCl4沸点为76.8℃,为保证稳定的CCl4气流,适宜的加热方式是___________。
(3)用如图装置制备CrCl3时,主要步骤包括:
①将产物收集到蒸发皿中;
②加热反应管至400℃,开始向三颈烧瓶中通入氮气,继续升温到650℃;
③三颈烧瓶中装入150mL CCl4,并加热CCl4,温度控制在50~60℃之间;
④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;
⑤停止加热CCl4,继续通入氮气;
⑥检查装置气密性。
正确的顺序为:__________________________。

(4)用如图装置制备CrCl3时,向三颈烧瓶中通入N2的作用为_______________________________
(5)制备CrC13时生成的气体COCl2(俗称光气)有毒,COCl2遇水发生水解,反应方程式为COCl2+H2O═CO2↑+CHCl,为了防止污染环境,用NaOH溶液吸吸收光气,其化学方程式为____________________________________________________________。
(6)仔细分析整套装置,为了制取并收集到纯净的CrCl3,明显有一个不足之处,你认为应该改进的一项措施是__________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com