
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,易水解,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因__________。
(2)已知CCl4沸点为76.8℃,为保证稳定的CCl4气流,适宜的加热方式是___________。
(3)用如图装置制备CrCl3时,主要步骤包括:
①将产物收集到蒸发皿中;
②加热反应管至400℃,开始向三颈烧瓶中通入氮气,继续升温到650℃;
③三颈烧瓶中装入150mL CCl4,并加热CCl4,温度控制在50~60℃之间;
④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;
⑤停止加热CCl4,继续通入氮气;
⑥检查装置气密性。
正确的顺序为:__________________________。

(4)用如图装置制备CrCl3时,向三颈烧瓶中通入N2的作用为_______________________________
(5)制备CrC13时生成的气体COCl2(俗称光气)有毒,COCl2遇水发生水解,反应方程式为COCl2+H2O═CO2↑+CHCl,为了防止污染环境,用NaOH溶液吸吸收光气,其化学方程式为____________________________________________________________。
(6)仔细分析整套装置,为了制取并收集到纯净的CrCl3,明显有一个不足之处,你认为应该改进的一项措施是__________________________________________________
【答案】除去其中可溶性杂质(或除去固体表面的重铬酸铵溶液) 水浴加热(并用温度计指示温度) ⑥③②④⑤① 赶尽反应装置中的氧气;②鼓气使反应物进入管式炉中进行反应 COCl2+4NaOH=Na2CO3+2NaCl+2H2O 在装置C和D之间连接一个盛有碱石灰的干燥管(或U形管)
【解析】
根据流程图分析各步发生的反应及分离的方法,根据题干信息判断相关物质的性质,进而分析该流程中的注意事项。
根据流程图知,重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)、氮气和水,然后洗涤、烘干得到Cr2O3,在加热条件下,在反应器中发生反应Cr2O3+3CCl4═2CrCl3+3COCl2,三氯化铬易升华,在高温下能被氧气氧化,为防止三氯化铬被氧化,通入氮气,且充入的氮气能使反应物进入管式炉中进行反应,最后得到无水三氯化铬;
(1)重铬酸铵分解不完全,还可能含有其它可溶性杂质,用蒸馏水洗涤除去其中可溶性杂质;故答案为:除去其中可溶性杂质;
(2)因为CCl4沸点为76.8℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量,并用温度计指示温度;
故答案为:水浴加热(并用温度计指示温度);
(3)由(5)可知反应制备原理为Cr2O3+3CCl4→2CrCl3+3COCl2,四氯化碳在管式炉中反应管与Cr2O3反应,反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源,停止加热CCl4,继续通入氮气,将产物收集到蒸发皿,故操作顺序为:⑥→③→②→④→⑤→①;
故答案为:⑥③②④⑤①;
(4)由题干信息知三氯化铬易升华,在高温下能被氧气氧化,所以通入氮气的作用是:①赶尽反应装置中的氧气;②鼓气使反应物进入管式炉中进行反应;故答案为:①赶尽反应装置中的氧气;②鼓气使反应物进入管式炉中进行反应;
(5)根据光气的水解产物CO2和HCl分别与NaOH反应生成Na2CO3和NaCl,书写用NaOH溶液吸收光气的化学方程式:COCl2+4NaOH=Na2CO3+2NaCl+2H2O;
(6)为防止三氯化铬水解,在装置C和D之间连接一个盛有碱石灰的干燥管(或U形管),故答案为:在装置C和D之间连接一个盛有碱石灰的干燥管(或U形管)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将NaOH、MgCl2、A1C13三种固体组成的混合物溶于足量水后得1.16g白色沉淀。在所得的浊液中逐滴加入1mo1·L-1HC1溶液,加入HC1溶液的体积与生成沉淀的质量关系如图所示,试回答:
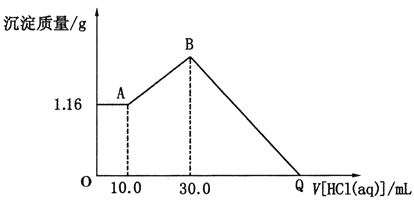
(1)写出混合物溶于水时发生反应的离子方程式:_____________________________。
(2)写出AB段反应的离子方程式:_______________________________。
(3)原混合物中NaOH的物质的量是多少?(写出计算过程) ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处于另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。D的周期序数等于D原子最外层电子数。E原子半径是同周期中最小的(除稀有气体外)。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是__________________ (用元素符号填写),其中D的最高价氧化物是________氧化物(填“酸性”“碱性”或“两性”)。
(2)乙物质中存在的化学键类型是________。
(3)化合物乙的电子式为________。
(4)写出C与D分别对应的最高价氧化物的水化物反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断正确的是

A. 最简单氢化物的沸点排序:Y>T>R
B. 原子半径和离子半径均满足:Y<Z
C. 最高价氧化物对应的水化物的酸性:T<R
D. 单质氧化性:Y>R>T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下。

(1)操作I、II中,不会用到的装置是________(填序号)。

(2)向干燥、破碎后的黄花蒿中加入乙醚的作用是________。
(3)操作III的目的是_________。
(4)某同学发现青蒿素可以使湿润的淀粉碘化钾试纸变蓝,依据此现象在其键线式上圈出对应的基团_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25molL﹣1min﹣1,下列说法正确的是( )
A. 该反应方程式中,x=1
B. 2min时,A的转化率为50%
C. 2min时,A的物质的量为0.75mol
D. 反应速率v(B)=0.25 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式下列判断正确的是( )
(i) I2(g)+H2(g)![]() 2HI(g)△H=﹣9.48kJ/mol
2HI(g)△H=﹣9.48kJ/mol
(ii) I2(S)+H2(g)![]() 2HI(g)△H=+26.48kJ.
2HI(g)△H=+26.48kJ.
A. 1 mol I2(g)中通入2gH2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(i)的产物比反应(ii)的产物稳定
D. 反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能获得成功的是
①将醋酸钠晶体与碱石灰混合加热来制取甲烷;
②将乙醇与浓硫酸共热至140°C来制取乙烯;
③在电石中加水制取乙炔;
④苯、浓溴水和铁粉混和,反应后可制得溴苯;
A.只有②B.只有①②C.只有①②④D.只有②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com