
【题目】![]() 作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。![]() 溶于
溶于![]() 溶液能发生
溶液能发生![]() 的反应,在低温条件下,可制得
的反应,在低温条件下,可制得![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A.其他条件相同的情况下,![]() 在
在![]() 溶液中的溶解度大于在水中的溶解度
溶液中的溶解度大于在水中的溶解度
B.向![]() 溶液中加入淀粉溶液,溶液变蓝色
溶液中加入淀粉溶液,溶液变蓝色
C.![]() 代替
代替![]() 作为加碘剂,可以减少碘的损失
作为加碘剂,可以减少碘的损失
D.由于还原性![]() ,加入
,加入![]() 可以提高加碘盐(添加
可以提高加碘盐(添加![]() )的稳定性
)的稳定性
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】苯丁酸氮芥(Ⅰ)是氮芥类抗癌药的代表物,其合成路线如下:
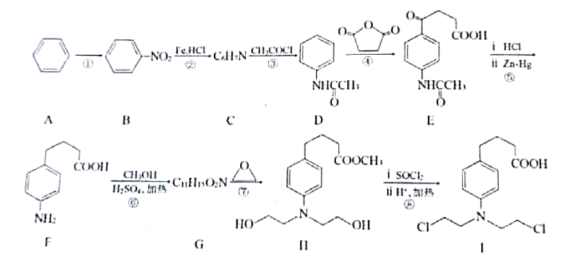
请回答:
(1)反应①所需的试剂和条件为_____________,B中官能团的名称为_________。
(2)C的结构简式为_________________,![]() 的名称为_________________。
的名称为_________________。
(3)满足下列条件的F的同分异构体有__________种(不考虑立体异构)。
a.属于芳香族化合物;
b.与F具有相同的官能团;
c.核磁共振氢谱有5组峰,且峰面积之比为6:2:2:2:1。
(4)⑤中步骤ⅱ的反应类型为_________。
(5)F→G的化学方程式为___________。
(6)设计由苯和![]() 制备
制备![]() 的合成路线___________(无机试剂任选)。
的合成路线___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,氧化剂与还原剂的物质的量之比是_____,当有2molHNO3参加反应时,被氧化的物质是____g,电子转移数目约为_____个。
(2)在反应K2S+4H2SO4(浓)![]() K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
(3)某同学写出以下三个化学方程式:(未配平)
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为不可能实现的是______。
(4)今有下列三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
氧化性最强的物质的是____(填字母,下同),若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是____。
A.Cl2 B.KMnO4 C.FeCl3 D.I2
(5)30mL浓度为0.05mol·L-1的Na2SO3溶液恰好与25mL浓度为0.02mol·L-1的K2R2O7溶液反应,则元素R在还原产物中的化合价是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO氧化反应:![]() 分两步进行,其反应过程能量变化示意图如图,下列说法不正确的是( )
分两步进行,其反应过程能量变化示意图如图,下列说法不正确的是( )
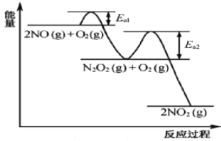
I.![]() H1;II.
H1;II.![]() H2
H2
A.由于![]() ,决定化学反应速率快慢的是反应Ⅱ
,决定化学反应速率快慢的是反应Ⅱ
B.图示过程中,反应物断键吸收能量小于生成物形成所释放的能量
C.升高温度,2NO(g)+O2(g)![]() 2NO2(g)反应速率一定加快
2NO2(g)反应速率一定加快
D.其它条件不变,升高温度,![]() 平衡一定逆向移动
平衡一定逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20g两种金属的混合物投入足量的稀硫酸中,反应完全后得到标准状况下H2 11.2L,则该混合物的组成可能是( )
A. Na和Fe B. Mg和Cu C. Al和Mg D. Zn和Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:
温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
①该反应正反应是___________(填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__________℃。
(2)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
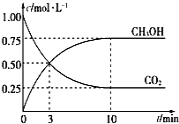
①该反应的平衡常数表达式为K=________;从反应开始到10min,v(H2)=______mol·L-1·min-1;
②下列情况能说明该反应一定达到平衡状态的是___________(填字母)
A.v(CO2)消耗=v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有___________ (填字母)
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度____________(填“>”、“<”或“=”)0.25mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是用途广泛的化工原料,主要应用于医药、日用化工等诸多领域。某兴趣小组制备流程如下:
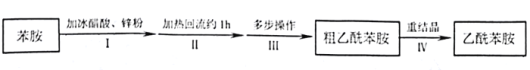
已知:
a.乙酰苯胺在水中的溶解度随温度的升高而增大
b.苯胺在空气中受热易被氧化
c.
名称 | 苯胺 | 醋酸 | 乙酰苯胺 |
沸点 | 184.4 | 117.9 | 304 |
d.反应原理:![]() +CH3COOH
+CH3COOH ![]()
![]() +H2O
+H2O
请回答:
(1)步骤Ⅰ,加入锌粉的目的__________。
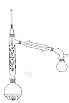
(2)步骤Ⅱ实验装置如图(加热装置省略),具体实验过程:装上一刺形分馏柱,插上温度计。用酒精灯加热,使反应溶液在微沸状态下回流,调节加热温度,使柱顶温度105℃左右,反应约![]() 。在反应瓶上装一个刺形分馏柱,其作用是__________。
。在反应瓶上装一个刺形分馏柱,其作用是__________。
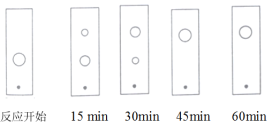
(3)步骤Ⅱ某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流![]() 、
、![]() 、
、![]() 和
和![]() 时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是______。
时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是______。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(4)步骤Ⅳ,关于重结晶的操作,下列说法正确的是________。
A.选蒸馏水作为重结晶提纯乙酰苯胺的溶剂
B.粗制的有机化合物中常常含有有色杂质,可用活性炭进行脱色
C.趁热过滤时,需将菊花形滤纸放入长颈玻璃漏斗,一并放入保温漏斗中
D.趁热过滤也可以用减压过滤代替,提前将布氏漏斗放在沸腾的水浴中加热,防止乙酰苯胺热溶液遇到冷的布氏漏斗而提前析出。
E.冷却结晶时一般是在室温下自然冷却。当溶液降至室温,析出大量乙酰苯胺晶体后,可用冰水进一步冷却,以便晶体析出更加彻底。
(5)物质制备时,通常对纯度有一定要求,从结构与性质角度分析,上述制备过程中“由非氧化还原反应”产生的杂质可能有__________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法错误的是

A. 该装置是将化学能转变为电能
B. 每得到1 mol草酸铝,电路中转移3mol电子
C. 正极的电极反应:2CO2 + 2e-=== C2O42-
D. 利用该技术可捕捉大气中的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉在社会生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。洪水过后,灾区人们的饮用水必须用漂白粉等药品消毒后才能饮用,以防传染病发生,但瓶装漂白粉久置空气中会呈稀粥状而失效。
(1)漂白粉可用来漂白或杀菌消毒,用化学方程式表示其原理:________________。
(2)用化学方程式表示漂白粉在空气中易失效的原因:________________________。
(3)已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com