
【题目】(1)参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:
温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
①该反应正反应是___________(填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__________℃。
(2)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
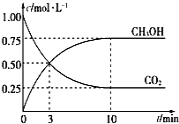
①该反应的平衡常数表达式为K=________;从反应开始到10min,v(H2)=______mol·L-1·min-1;
②下列情况能说明该反应一定达到平衡状态的是___________(填字母)
A.v(CO2)消耗=v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有___________ (填字母)
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度____________(填“>”、“<”或“=”)0.25mol·L-1。
【答案】放热 50 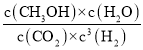 0.225 CD AC >
0.225 CD AC >
【解析】
(1)①根据温度与化学平衡常数的关系,结合平衡移动原理分析;
②根据CO的平衡转化率计算该反应的平衡常数,结合表格数据判断反应进行的温度;
(2)①根据平衡常数的含义书写表达式,先根据图象计算v(CO2),然后根据反应速率与化学计量数关系计算从反应开始到10min的v(H2);
②根据可逆反应达到平衡状态时各种物质的浓度不变,含量不变,正逆反应速率不变分析;
③根据影响反应速率的因素和化学平衡影响因素分析判断;
④根据等效平衡分析判断。
(1)①根据表格数据可知:升高温度,该反应的化学平衡常数降低,说明:升高温度化学平衡逆向移动,由于升高温度化学平衡向吸热反应方向移动,逆反应为吸热反应,则该反应的正反应为放热反应;
②在T℃时,在1L密闭容器中,投入0.1molCO和0.2molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g),达到平衡时,CO转化率为50%,则反应的CO物质的量浓度为0.05mol/L,则同时反应消耗H2的浓度为0.1mol/L,反应产生的CH3OH(g)浓度为0.05mol/L,则平衡时c(CO)=0.05mol/L,c(H2)=0.1mol/L,则该温度下的化学平衡常数K=
CH3OH(g),达到平衡时,CO转化率为50%,则反应的CO物质的量浓度为0.05mol/L,则同时反应消耗H2的浓度为0.1mol/L,反应产生的CH3OH(g)浓度为0.05mol/L,则平衡时c(CO)=0.05mol/L,c(H2)=0.1mol/L,则该温度下的化学平衡常数K=![]() =100,根据温度与化学平衡常数的关系可知:反应温度为50℃;
=100,根据温度与化学平衡常数的关系可知:反应温度为50℃;
(2)①化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比,对于反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),其平衡常数表达式为K=
CH3OH(g)+H2O(g),其平衡常数表达式为K=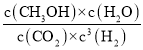 ;从反应开始到10min,v(CO2)=
;从反应开始到10min,v(CO2)=![]() =0.075mol/(L·min),由于反应用不同物质表示反应速率,速率比等于化学方程式中化学计量数的比,所以从反应开始到10min,v(H2)=3v(CO2)=0.225mol/(L·min);
=0.075mol/(L·min),由于反应用不同物质表示反应速率,速率比等于化学方程式中化学计量数的比,所以从反应开始到10min,v(H2)=3v(CO2)=0.225mol/(L·min);
②A.v(CO2)消耗 =v(CH3OH)生成表示的是反应正向进行,不能说明为平衡状态,A错误;
B.容器的容积不变,反应混合物都是气体,在任何条件下气体的密度都不变,因此不能根据气体的密度不再随时间改变判断反应处于平衡状态,B错误;
C.CO2和CH3OH的浓度之比不再随时间改变,说明反应混合物中任何物质的浓度不变,反应处于平衡状态,C正确;
D.反应前后气体的质量不变,而气体的物质的量改变,若反应混合物中,气体的平均相对分子质量不再随时间改变,说明气体的物质的量不再发生变化,反应达到平衡状态,D正确;
故合理选项是CD;
③A.升高温度化学反应速率增大,化学平衡向吸热的逆反应方向移动,气体的物质的量增大,A符合题意;
B.缩小容器体积物质的浓度增大,反应速率加快,反应体系压强也随之增大,增大压强,平衡向气体体积减小的正反应方向移动,气体的物质的量减小,B不符合题意;
C.再充入CO2气体,即增大了反应物的浓度,化学反应速率增大,化学平衡正向移动,总的来说气体的物质的量比原来增大,C符合题意;
D.使用合适的催化剂,化学反应速率加快,但化学平衡不发生移动,因此气体的物质的量不变,D不符合题意;
故合理选项是AC;
④对于反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在体积为1L的密闭容器中,充入lmolCO2和3molH2,由于该反应是反应前后气体体积不等的反应,所以其等效起始状态为向该容器中加入1mol CH3OH(g)和1molH2O(g),而现在是在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),相当于在1L密闭容器中加入1mol CH3OH(g)和1molH2O(g),反应达到平衡后再加入1mol CH3OH(g)和1molH2O(g),所以达到新的平衡时CO2的浓度大于原平衡时的浓度0.25mol/L。
CH3OH(g)+H2O(g),在体积为1L的密闭容器中,充入lmolCO2和3molH2,由于该反应是反应前后气体体积不等的反应,所以其等效起始状态为向该容器中加入1mol CH3OH(g)和1molH2O(g),而现在是在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),相当于在1L密闭容器中加入1mol CH3OH(g)和1molH2O(g),反应达到平衡后再加入1mol CH3OH(g)和1molH2O(g),所以达到新的平衡时CO2的浓度大于原平衡时的浓度0.25mol/L。


科目:高中化学 来源: 题型:
【题目】如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5 mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
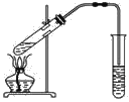
(1)写出左试管中主要反应的化学方程式:_________________________________。
(2)加入浓硫酸的作用:_________________。
(3)反应开始时用酒精灯对左试管小火加热的原因是____________________________(已知乙酸乙酯的沸点为77 ℃;乙醇的沸点为78.5 ℃;乙酸的沸点为117.9 ℃);后改用大火加热的目的是______。
(4)分离右试管中所得乙酸乙酯和饱和Na2CO3溶液的操作为________(只填名称),所需主要仪器为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法不正确的是( )
为阿伏加德罗常数的值。下列说法不正确的是( )
A.![]() 与过量浓硝酸反应,收集到
与过量浓硝酸反应,收集到![]() 气体(标准状况),则被还原的硝酸的数目是0.06NA
气体(标准状况),则被还原的硝酸的数目是0.06NA
B.常温常压下,![]() 的乙二酸溶液中,总的离子数目大于0.15NA
的乙二酸溶液中,总的离子数目大于0.15NA
C.常温常压下,![]() 与足量
与足量![]() 反应,共生成
反应,共生成![]() 转移电子的数目为0.4NA
转移电子的数目为0.4NA
D.含![]() 与
与![]() 共
共![]() 的溶液中,N(
的溶液中,N(![]() )+N
)+N![]() )+N(H2CO3)=NA
)+N(H2CO3)=NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A. 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成Cl2分子数为0. 3 NA
B. 80gSO3在标准状况下所占体积约为22.4L
C. 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,转移的电子的数目为NA
D. 5.4g铝粉与足量的氢氧化钠溶液充分反应生成H2分子数为0. 3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。![]() 溶于
溶于![]() 溶液能发生
溶液能发生![]() 的反应,在低温条件下,可制得
的反应,在低温条件下,可制得![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A.其他条件相同的情况下,![]() 在
在![]() 溶液中的溶解度大于在水中的溶解度
溶液中的溶解度大于在水中的溶解度
B.向![]() 溶液中加入淀粉溶液,溶液变蓝色
溶液中加入淀粉溶液,溶液变蓝色
C.![]() 代替
代替![]() 作为加碘剂,可以减少碘的损失
作为加碘剂,可以减少碘的损失
D.由于还原性![]() ,加入
,加入![]() 可以提高加碘盐(添加
可以提高加碘盐(添加![]() )的稳定性
)的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下方法来合成甲醇:
(1)用CO2生产甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:____________________。
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) ![]() CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度 B. 将CH3OH(g)从体系中分离
C.使用合适的催化剂 D. 充入He,使体系总压强增大
(3)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是________________________,正极发生的电极反应式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备![]() 的部分装置如图所示。请回答:
的部分装置如图所示。请回答:
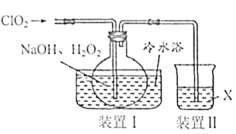
(1)装置I中反应生成![]() 的化学方程式为___________。
的化学方程式为___________。
(2)已知在![]() 饱和溶液中温度低于38℃时析出的晶体是
饱和溶液中温度低于38℃时析出的晶体是![]() ,温度高于38℃时析出的晶体是
,温度高于38℃时析出的晶体是![]() ,温度高于60℃时
,温度高于60℃时![]() 分解生成
分解生成![]() 和
和![]() 。请补充从装置Ⅰ反应后的溶液中获得
。请补充从装置Ⅰ反应后的溶液中获得![]() 晶体的操作步骤:①减压,55℃蒸发结晶;②_________;③__________;④___________;得到成品。
晶体的操作步骤:①减压,55℃蒸发结晶;②_________;③__________;④___________;得到成品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2份50mL同样的NaOH的溶液,分别向其中逐渐通入一定量的CO2,得到甲和乙 两种溶液,在甲和乙溶液中分别逐渐加入1mol/LHCl的盐酸溶液,产生的二氧化碳气体(标准状况)与所加入盐酸的体积之间的关系如图所示的关系。
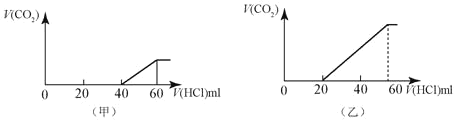
请回答下列问题:
(1)甲溶液中的溶质是____,其物质的量的比值是____。
(2)乙溶液中的溶质是____,其物质的量的比值是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)室温下,2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,写出1molC6H6完全燃烧的热化学方程式:______。
(2)已知:Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s)△H=+akJmol-1;C(s)+O2(g)=CO2(g)△H=-bkJmol-1,则2Fe(s)+
CO2(g)+2Fe(s)△H=+akJmol-1;C(s)+O2(g)=CO2(g)△H=-bkJmol-1,则2Fe(s)+![]() O2(g)=Fe2O3(s)的△H=________。
O2(g)=Fe2O3(s)的△H=________。
(3)已知几种化学键的键能如表所示:
化学键 | Cl—Cl | F—F | Cl—F |
键能/ kJ·mol—1 | 242 | 159 | 172 |
则反应Cl2(g)+3F2(g)![]() 2ClF3(g)的△H=_____________ kJ·mol-1。
2ClF3(g)的△H=_____________ kJ·mol-1。
(4)如图是乙烷、二甲醚燃烧过程中的能量变化图。
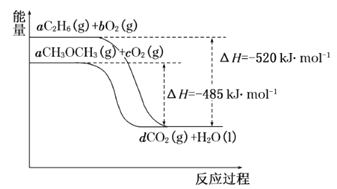
请回答下列问题:
①乙烷的燃烧热ΔH=_______kJ·mol-1。
②根据题图写出二甲醚完全燃烧时的热化学方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com