
【题目】2份50mL同样的NaOH的溶液,分别向其中逐渐通入一定量的CO2,得到甲和乙 两种溶液,在甲和乙溶液中分别逐渐加入1mol/LHCl的盐酸溶液,产生的二氧化碳气体(标准状况)与所加入盐酸的体积之间的关系如图所示的关系。
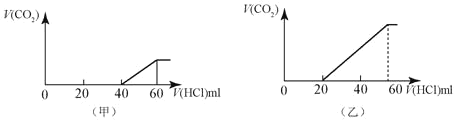
请回答下列问题:
(1)甲溶液中的溶质是____,其物质的量的比值是____。
(2)乙溶液中的溶质是____,其物质的量的比值是____。
【答案】NaOH、Na2CO3 1:1 NaHCO3、Na2CO3 1:1
【解析】
当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑。
(1)甲中生成CO2气体至最大,消耗HCl为20mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为20mL,而图象中开始生成CO2气体时消耗HCl体积为60mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为60mL-20mL-20mL=20mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比;
(2)乙中生成CO2气体至最大,消耗HCl为60mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为40mL,而图象中开始生成CO2气体时消耗HCl体积为20mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3;中和Na2CO3消耗HCl的体积为20mL,根据反应消耗盐酸的体积计算NaHCO3、Na2CO3的物质的量之比。
(1) 甲中生成CO2气体至最大,消耗HCl为20mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为20mL,而图象中开始生成CO2气体时消耗HCl体积为60mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为60mL-20mL-20mL=20mL,由方程式可知NaOH、Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=20mL:20mL=1:1;
故答案为:NaOH、Na2CO3;1:1;
(2) 乙中生成CO2气体至最大,消耗HCl为60mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为40mL,而图象中开始生成CO2气体时消耗HCl体积为20mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3;中和Na2CO3消耗HCl的体积为20mL,由方程式可知NaHCO3、Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaHCO3、Na2CO3的物质的量之比=20mL:20mL=1:1;
故答案为:NaHCO3、Na2CO3;1:1。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.常温下,pH=7的溶液不一定是纯水
B.常温下,某氨水pH=x,某盐酸pH=14-x,两者等体积混合后,pH>7
C.相同温度下,pH相等的盐酸、CH3COOH溶液中,c(CH3COO-)= c(Cl-)
D.氨水和硫酸反应后的溶液,若溶液呈中性,则c(![]() )=c(
)=c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:
温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
①该反应正反应是___________(填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__________℃。
(2)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
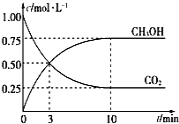
①该反应的平衡常数表达式为K=________;从反应开始到10min,v(H2)=______mol·L-1·min-1;
②下列情况能说明该反应一定达到平衡状态的是___________(填字母)
A.v(CO2)消耗=v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有___________ (填字母)
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度____________(填“>”、“<”或“=”)0.25mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧氟沙星是常用抗菌药,其结构简式如图所示,下列对氧氟沙星叙述错误的是
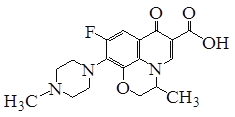
A.能发生加成、取代反应
B.能发生还原、酯化反应
C.分子内共有19个氢原子
D.分子内共平面的碳原子多于6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法错误的是

A. 该装置是将化学能转变为电能
B. 每得到1 mol草酸铝,电路中转移3mol电子
C. 正极的电极反应:2CO2 + 2e-=== C2O42-
D. 利用该技术可捕捉大气中的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的能量变化示意图如下,有关说法正确的是( )
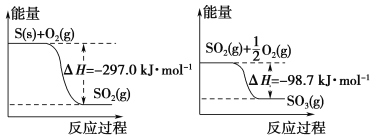
A. 1 mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量小于297.0 kJ
B. 在相同条件下,SO2(g)比SO3(g)稳定
C. S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=+395.7 kJ·mol-1
SO3(g) ΔH=+395.7 kJ·mol-1
D. 一定条件下1 mol SO2(g)和![]() mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ
mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
(1)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是___。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
(2)2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。

①用A、B、O表示这类特殊晶体的化学式:___。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁转变及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:___。(用含x的代数式表示)
③Mn的核外电子排布式为:___。
④下列有关说法正确的是___。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是___________,产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是___________。
(3)③中所发生的各反应的离子方程式是___________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效脱除烟气中的SO2是环境保护的重要课题。
(1)氨水可以脱除烟气中的SO2。氨水脱硫的相关热化学方程式如下:
2NH3(g) +H2O(l) +SO2(g) =(NH4)2SO3(aq) ΔH= akJ·mol1
(NH4)2SO3(aq)+H2O(l) +SO2(g) =2NH4HSO3(aq) ΔH = bkJ·mol1
2(NH4)2SO3(aq) +O2(g) =2(NH4)2SO4(aq) ΔH =ckJ·mol1
反应NH3(g) +NH4HSO3(aq) +![]() O2(g) = (NH4)2SO4(aq)的ΔH=____kJ·mol1。
O2(g) = (NH4)2SO4(aq)的ΔH=____kJ·mol1。
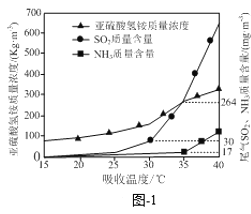
已知:SO2的国家排放标准为80mg·m3。氨水脱除烟气中的SO2是在吸收塔中进行的,控制其他实验条件相同,仅改变吸收塔的温度,实验结果如题图-1所示,为了尽可能获得NH4HSO3,则吸收塔合适的温度约为________。
A.25℃ B.31℃ C.35℃
(2)电解法可以脱除烟气中的SO2。用Na2SO4溶液吸收烟气中的SO2,使用惰性电极电解吸收后的溶液,H2SO3在阴极被还原为硫单质,阴极的电极反应式为_______。
(3)钠钙双碱法可高效脱除烟气中的SO2,脱硫的流程如题图-2所示。
①“吸收”时气液逆流在吸收塔中接触,吸收时不宜直接使用石灰乳的原因是_______。
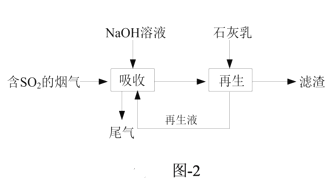

②水溶液中H2SO3、HSO![]() 、SO
、SO![]() 随pH的分布如题图3所示,“再生液”用NaOH溶液调pH至7~9得到溶液X,溶液X吸收SO2时主要反应的离子方程式为______。
随pH的分布如题图3所示,“再生液”用NaOH溶液调pH至7~9得到溶液X,溶液X吸收SO2时主要反应的离子方程式为______。
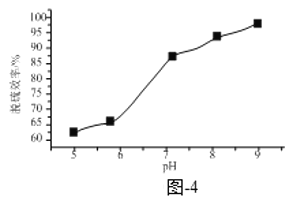
③已知Na2SO3的溶解度随着pH增大而减小。溶液X的pH对脱硫效率的影响如题图-4所示。当pH由6升高到7时,脱硫效率迅速增大的原因为______;当pH大于7时,随pH增大脱硫效率增速放缓的原因为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com