
【题目】氧氟沙星是常用抗菌药,其结构简式如图所示,下列对氧氟沙星叙述错误的是
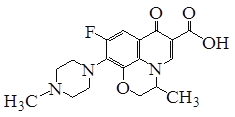
A.能发生加成、取代反应
B.能发生还原、酯化反应
C.分子内共有19个氢原子
D.分子内共平面的碳原子多于6个
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5 mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
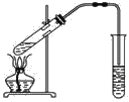
(1)写出左试管中主要反应的化学方程式:_________________________________。
(2)加入浓硫酸的作用:_________________。
(3)反应开始时用酒精灯对左试管小火加热的原因是____________________________(已知乙酸乙酯的沸点为77 ℃;乙醇的沸点为78.5 ℃;乙酸的沸点为117.9 ℃);后改用大火加热的目的是______。
(4)分离右试管中所得乙酸乙酯和饱和Na2CO3溶液的操作为________(只填名称),所需主要仪器为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A. 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成Cl2分子数为0. 3 NA
B. 80gSO3在标准状况下所占体积约为22.4L
C. 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,转移的电子的数目为NA
D. 5.4g铝粉与足量的氢氧化钠溶液充分反应生成H2分子数为0. 3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下方法来合成甲醇:
(1)用CO2生产甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:____________________。
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) ![]() CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度 B. 将CH3OH(g)从体系中分离
C.使用合适的催化剂 D. 充入He,使体系总压强增大
(3)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是________________________,正极发生的电极反应式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备![]() 的部分装置如图所示。请回答:
的部分装置如图所示。请回答:
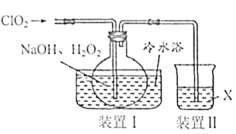
(1)装置I中反应生成![]() 的化学方程式为___________。
的化学方程式为___________。
(2)已知在![]() 饱和溶液中温度低于38℃时析出的晶体是
饱和溶液中温度低于38℃时析出的晶体是![]() ,温度高于38℃时析出的晶体是
,温度高于38℃时析出的晶体是![]() ,温度高于60℃时
,温度高于60℃时![]() 分解生成
分解生成![]() 和
和![]() 。请补充从装置Ⅰ反应后的溶液中获得
。请补充从装置Ⅰ反应后的溶液中获得![]() 晶体的操作步骤:①减压,55℃蒸发结晶;②_________;③__________;④___________;得到成品。
晶体的操作步骤:①减压,55℃蒸发结晶;②_________;③__________;④___________;得到成品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二〇〇八年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenynol)。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是( )
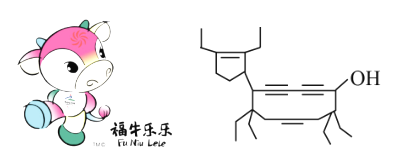
A.牛式二烯炔醇含有3种官能团,可以属于不饱和醇类
B.牛式二烯炔醇含有3个手性碳原子,与氢气完全加成反应后含有4个手性碳原子
C.1mol牛式二烯炔醇最多可与6molBr2发生加成反应
D.牛式二烯炔醇分子内能发生消去反应,也能发生催化氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2份50mL同样的NaOH的溶液,分别向其中逐渐通入一定量的CO2,得到甲和乙 两种溶液,在甲和乙溶液中分别逐渐加入1mol/LHCl的盐酸溶液,产生的二氧化碳气体(标准状况)与所加入盐酸的体积之间的关系如图所示的关系。
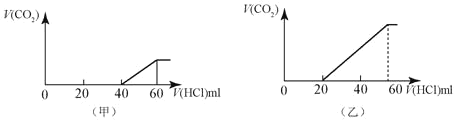
请回答下列问题:
(1)甲溶液中的溶质是____,其物质的量的比值是____。
(2)乙溶液中的溶质是____,其物质的量的比值是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
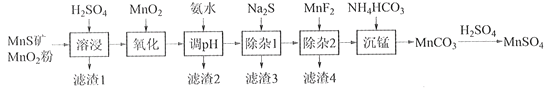
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19.2 g Cu加入到100 mL一定浓度的硝酸溶液中,假定两者恰好完全反应,同时产生标准状况下8.96 L NO和NO2的混合气体(忽略气体的溶解及转化)。求:
(1)混合气体中NO和NO2的体积比。_____________
(2)硝酸溶液的物质的量浓度。__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com