
【题目】下列说法不正确的是( )
A.常温下,pH=7的溶液不一定是纯水
B.常温下,某氨水pH=x,某盐酸pH=14-x,两者等体积混合后,pH>7
C.相同温度下,pH相等的盐酸、CH3COOH溶液中,c(CH3COO-)= c(Cl-)
D.氨水和硫酸反应后的溶液,若溶液呈中性,则c(![]() )=c(
)=c(![]() )
)
【答案】D
【解析】
A.常温下,pH=7的溶液可能是纯水,也可能是NaCl溶液或CH3COONH4溶液等,A正确;
B.常温下,某氨水pH=x,某盐酸pH=14-x,两者等体积混合后,溶液中的OH-与H+正好完全反应,但过量的氨水仍会电离出OH-,所以溶液呈碱性,pH>7,B正确;
C.相同温度下,pH相等的盐酸、CH3COOH溶液中氢离子浓度相等,由于水的离子积相同,则两溶液中c(OH-)相等,根据电荷守恒可知,c(CH3COO-)=c(Cl-),C正确;
D.氨水和硫酸反应后的溶液,满足电荷守恒:2c(![]() )+c(OH-)=c(
)+c(OH-)=c(![]() )+c(H+),若溶液呈中性,则c(H+)=c(OH-),从而得出2c(
)+c(H+),若溶液呈中性,则c(H+)=c(OH-),从而得出2c(![]() )=c(
)=c(![]() ),D不正确;
),D不正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中发生反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是( )
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是( )
A. 用A表示的反应速率是0.4 mol·L-1·min-1
B. 2 min末的反应速率v(C)=0.3 mol·L-1·min-1
C. 2 min内D的物质的量增加0.2mol
D. 若起始时A、B的物质的量之比为4:3,则2 min末A、B的转化率之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5 mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
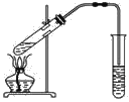
(1)写出左试管中主要反应的化学方程式:_________________________________。
(2)加入浓硫酸的作用:_________________。
(3)反应开始时用酒精灯对左试管小火加热的原因是____________________________(已知乙酸乙酯的沸点为77 ℃;乙醇的沸点为78.5 ℃;乙酸的沸点为117.9 ℃);后改用大火加热的目的是______。
(4)分离右试管中所得乙酸乙酯和饱和Na2CO3溶液的操作为________(只填名称),所需主要仪器为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5 mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
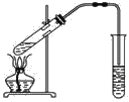
(1)写出左试管中主要反应的化学方程式:_________________________________。
(2)加入浓硫酸的作用:_________________。
(3)反应开始时用酒精灯对左试管小火加热的原因是____________________________(已知乙酸乙酯的沸点为77 ℃;乙醇的沸点为78.5 ℃;乙酸的沸点为117.9 ℃);后改用大火加热的目的是______。
(4)分离右试管中所得乙酸乙酯和饱和Na2CO3溶液的操作为________(只填名称),所需主要仪器为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列变化的离子方程式是( )
A.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:![]()
B.用铝粉和![]() 溶液反应制取少量H2:
溶液反应制取少量H2:![]()
C.四氧化三铁溶于稀硝酸:![]()
D.漂白粉溶液中通入足量SO2:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法不正确的是( )
为阿伏加德罗常数的值。下列说法不正确的是( )
A.![]() 与过量浓硝酸反应,收集到
与过量浓硝酸反应,收集到![]() 气体(标准状况),则被还原的硝酸的数目是0.06NA
气体(标准状况),则被还原的硝酸的数目是0.06NA
B.常温常压下,![]() 的乙二酸溶液中,总的离子数目大于0.15NA
的乙二酸溶液中,总的离子数目大于0.15NA
C.常温常压下,![]() 与足量
与足量![]() 反应,共生成
反应,共生成![]() 转移电子的数目为0.4NA
转移电子的数目为0.4NA
D.含![]() 与
与![]() 共
共![]() 的溶液中,N(
的溶液中,N(![]() )+N
)+N![]() )+N(H2CO3)=NA
)+N(H2CO3)=NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A. 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成Cl2分子数为0. 3 NA
B. 80gSO3在标准状况下所占体积约为22.4L
C. 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,转移的电子的数目为NA
D. 5.4g铝粉与足量的氢氧化钠溶液充分反应生成H2分子数为0. 3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2份50mL同样的NaOH的溶液,分别向其中逐渐通入一定量的CO2,得到甲和乙 两种溶液,在甲和乙溶液中分别逐渐加入1mol/LHCl的盐酸溶液,产生的二氧化碳气体(标准状况)与所加入盐酸的体积之间的关系如图所示的关系。
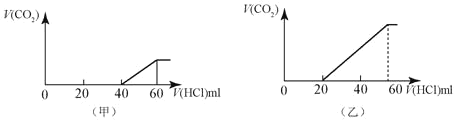
请回答下列问题:
(1)甲溶液中的溶质是____,其物质的量的比值是____。
(2)乙溶液中的溶质是____,其物质的量的比值是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com