
����Ŀ����ͼ��ʾ:��B����װ��100mLˮ,�ݻ�Ϊa mL���Թ�A������NO2��NO�Ļ������(��״��),���Թ�A������B�۵�ˮ��,��ַ�Ӧ,�Թ�A��������������Ϊ0.6amL��

(1)��A������Bˮ���з����ķ�ӦΪ________________________________ ,�÷�Ӧ���������뻹ԭ����������Ϊ__________ ,ԭ���������NO2��NO�����ʵ���֮��Ϊ________��
(2)ͨ��������C������������Թ�A�л�������ͨ������,A�п��ܹ۲쵽��������: __________��
(3)���Թ�A�г�������ʱֹͣͨ������,Ȼ���Թ�ȡ��ˮ��,ˮ��B����Һ�����ʵ���Ũ��Ϊ_________ (����Һ�������Ϊ100mL)��
���𰸡� 3NO2��H2O��2HNO3��NO 1:2 3��2 ��ɫ�����Ϊ����ɫ���壬�Թ���Һ�治��������ȫ����������ͨ���������Թ���Һ���½�����������ɫ���� a/2240
��������(1)������������ˮ���������NO����A������Bˮ���з����ķ�ӦΪ3NO2��H2O��2HNO3��NO���÷�Ӧ���������������NO�ǻ�ԭ���NO2����������Ҳ�ǻ�ԭ�������������뻹ԭ����������Ϊ1:2��������NO2��NO�Ļ�����壨��״�����Թ�A������ˮ�г�ַ�Ӧ���Թ�A��������������Ϊ0.6a mL������ݷ���ʽ��֪
3NO2��H2O��2HNO3��NO ������١�V
3 2
V amL-0.6amL=0.4amL
���V��0.6amL����NO���ΪamL-0.6amL=0.4amL����n��NO2����n��NO����3��2��
(2)ͨ��������C������������Թ�A�л�������ͨ��������NO��������Ӧ���ɶ���������������������ˮ�ֲ���ѧ����NO����A�п��ܹ۲쵽����������ɫ�����Ϊ����ɫ���壬�Թ���Һ�治��������ȫ����������ͨ���������Թ���Һ���½�����������ɫ���壻
(3)���ݵ�Ԫ���غ��֪��ˮ����������������ʵ���Ϊ��n��HNO3����n��NO2��+n��NO����![]() ���������Ũ��Ϊ
���������Ũ��Ϊ![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(TiCl4)����ȡ���캽�չ�ҵ���������ѺϽ����Ҫԭ�ϡ���������(��Ҫ�ɷ���FeTiO3)�Ʊ�TiCl4�Ȳ�Ʒ��һ�ֹ�������ʾ�����£�

�ش��������⣺
(1)�����м�����м������Һ����ɫ����ʱ��Һ�Գ�ǿ���ԡ��ù����������·�Ӧ������
2Fe3����Fe=3Fe2��
2TiO2��(��ɫ)��Fe��4H��=2Ti3��(��ɫ)��Fe2����2H2O
Ti3��(��ɫ)��Fe3����H2O=TiO2��(��ɫ)��Fe2����2H��
������������� ��
(2)���ڡ������չ�������Ҫ�����������γ�TiO2��nH2O�ܽ������ܽ��ķ�ɢ�ʿ���ֱ����С�� ��Χ��
(3)���������ƵõĹ���TiO2��nH2O������ϴ��ȥ���е�Fe(OH)3���ʣ������Ƶ��Ѱۡ���֪25 ��ʱ��Ksp[Fe(OH)3]��2.79��10��39�����¶��·�ӦFe(OH)3��3H��Fe3����3H2O��ƽ�ⳣ��K�� ��
(4)��֪��TiO2(s)��2Cl2(g)=TiCl4(l)��O2(g) ��H����140 kJ��mol��1
2C(s)��O2(g)=2CO(g) ��H����221 kJ��mol��1
д������TiO2�ͽ�̿��������Ӧ����Һ̬TiCl4��CO������Ȼ�ѧ����ʽ�� ��
(5)�������վ��гɱ��͡����õ�Ʒλ����Ϊԭ�ϵ��ŵ㡣������ɫ��ѧ����ù��������д��ڵIJ���֮���� (ֻҪ��д��һ��)��
(6)�����±���Ϣ��Ҫ���ƺ�����SiCl4���ʵ�TiCl4���ɲ��� ������
TiCl4 | SiCl4 | |
�۵�/�� | ��25.0 | ��68.8 |
�е�/�� | 136.4 | 57.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��8�£����Ϲ������ƻ������й��������⾭��ʾ���������ڽ�������仧����������H2��̼���ܵȲ��������Ķ��ε�ص�ԭ����ͼ��ʾ������˵����ȷ����
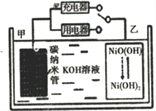
A. ���ʱ����ص�̼�缫��ֱ����Դ����������
B. �ŵ�ʱ���缫Ϊ�������缫��ӦΪ�� H2-2e�T2H+
C. ���ʱ���ҵ缫��ӦʽΪ��NiO(OH)+H2O+e�TNi(OH)2+OH
D. ����ܷ�ӦΪH2+2NiO(OH)![]() 2Ni(OH)2
2Ni(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��C��s��+O2��g���TCO2��g����H=��393.5kJmol��12H2��g��+O2��g���T2H2O��g����H=��483.6kJmol��1
����0.2mol��̿�ۺ�������ɵ����������һ��������������ȫȼ�գ����ų�63.53kJ��������������C��H2�����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����ͬѧΪ̽��SO2������Ա���ǿ�����ܷ�Ӧ���ɰ�ɫBaSO3����������ͼ��ʾװ�ý���ʵ�����г�װ�ú�A�м���װ�����ԣ��������Ѽ�������
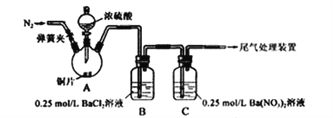
ʵ�����������
���� | ���� |
�رյ��ɼУ��μ�һ����Ũ���ᣬ���� | A���а������ɣ�ͭƬ����������� B��������ð��������������ɫ���� C�в�����ɫ������Һ���Ϸ�����dz��ɫ������ʧ |
���ɼУ�ͨ��N2��ֹͣ���ȣ�һ��ʱ���ر� | |
��B��C�зֱ�ȡ������ɫ��������ϡ���� | ��δ���ְ�ɫ�����ܽ� |
��1��A�з�Ӧ�Ļ�ѧ����ʽ��_________________��
��2��C�����ɰ�ɫ���������ӷ���ʽΪ__________________��
��3������B�в�����ϡ����ij���������ԭ����Ϊ�ǿ������뷴Ӧ������Ϊ�ǰ������뷴Ӧ��Ϊ֤ʵ���ԵĹ۵㣬��ԭʵ������ϣ��ס�����ͬѧ�ֱ���������ʵ�飺����ԭ�в���֮ǰͨN2,һ��ʱ�䣬B�в���������ɫ����������A��B������ʢ�ű���NaHSO3��Һ��ϴ��ƿ��B����������ɫ��������������������ԭ����_____________��
��4����ϣ�3������ͬѧ��ʵ����������Ϊԭʵ��B�в���������ɫ��������Ҫԭ����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺
��1����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ�����߸����뼸�η�̪��Һ���ٵ�����X���ϵĵ缫��ӦʽΪ����X�������۲쵽�������� ��
��Y�缫�ϵĵ缫��ӦʽΪ������õ缫��Ӧ����ķ����� ��
��2�����õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ�����X�缫�IJ����� �� �缫��ӦʽΪ ��
��Y�缫�IJ����� �� �缫��ӦʽΪ �� ��˵�������ʷ����ĵ缫��Ӧ����д����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����������Ļ�ѧҩƷ������ǡ���ķ�������ķ�������ȥij��Һ���ܽ�����ʣ�������������ȷ���ǣ������ڵ�����Ϊ���ʣ���������
A. N2��O2����ͨ�����ȵ�CuO��ĩ���ռ�����
B. KNO3��Һ��AgNO3����������KCl��Һ������
C. NaCl��Һ��I2�����Ӿƾ�����ȡ��Һ
D. CO2��HCl����ͨ��NaOH��Һ��ϴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�ͭ��(��Ҫ�ɷ���CuFeS2������������SiO2)Ϊԭ����ͭ�ķ�����Ϊ������ͭ��ʪ����ͭ���֡���������ʪ����ͭ�����½�չ����ѧ�ҷ�����һ��ϸ��������ˮ��Һ�����������£����Խ���ͭ�������������Σ�ij�������ø�ԭ������ͭ���̷���FeSO4�ľ��壬���ᾧˮ����
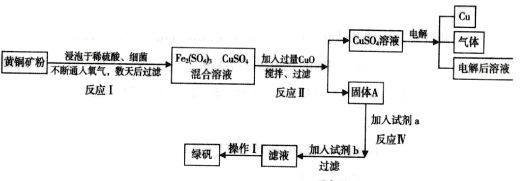
�ش��������⣺
��1��д����Ӧ���Ļ�ѧ��Ӧ����ʽ��__________________________��
��2����ӦII��CuO��������_________________________��
��3��д�������Լ�b�����ķ�Ӧ���ӷ���ʽ_________________________________________��
��4��������Һ�л���̷����壬�������IӦΪ___________________________��
��5�����������У���ѭ��ʹ�õ�������__________________��д��ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�ۺ�����Ҫ���Ͽɳ�����չ��ԭ�������Ϲ�ҵ��ϵ(����)��ͼ��ʾ��
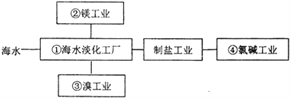
����˵������ȷ����
A. ���пɲ��÷���Ĥ�����÷��õ��İ�Ĥ��������������
B. ���й�ҵ��Ҫ�ƽ���þ����ͨ����ⱥ���Ȼ�þ��Һ�ķ�������ȡ
C. ����������Ҫ�Ժ�����Һ���л��ܼ����и������ò�����Ϊ��ȡ
D. �����ȼҵ��ⱥ��ʳ��ˮ�����õ��������ӽ���Ĥ�����е��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com