
【题目】四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
【答案】(1)使Fe3+还原为Fe2+;保护TiO2+不被Fe3+氧化
(2)10-9 m~10-7 m(或其他合理答案)
(3)2.79×103
(4)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1
(5)产生三废(或其他合理答案)
(6)蒸馏(或分馏或精馏)
【解析】试题分析:(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有钛离子,由方程式可知,铁离子氧化钛离子,加入铁屑做还原剂,将铁离子还原为亚铁离子,生成Ti3+,保护Fe2+不被氧化。(2)控制调价以形成溶胶,说明得到胶体,其分散质颗粒直径为10-9~10-7m。(3)平衡常数=c(Fe3+)/(H+)3=Ksp/KW=2.79×10-39/(10-14)3=2.79×103。(4)根据盖斯定律分析反应①+反应②即可,得到热化学方程式为:TiO2(s)+2C(s)+2Cl2(g)=TiCl4(l)+2CO(g) △H=-81kJ·mol-1。(5)由工艺流程可知,生成中产生废气、废液、废渣等不符合绿色化学理念。(6)由表中数据分析可知,SiCl 4和TiCl 4,为液体,要精制含有少量SiCl 4杂质的TiCl 4,可采用蒸馏或分馏的方法。


科目:高中化学 来源: 题型:
【题目】下列关于溶液的叙述中不正确的是
A. 等pH的盐酸与醋酸稀释后pH的变化如下图所示,则曲线II表示的是醋酸的稀释图象

B. 溶有等物质的量的NaCN、NaHCO3的溶液中:c(HCN)+C(CN-)=c(HCO3-)+c(H2CO3)+c(CO32-)
C. 25℃时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的溶溶液体积液等体积混合后pH=4:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
D. 已知某温度下Ksp(CH3COOAg)=2.8×10-3,浓度均为0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氯水分别与如图四种物质发生的反应选择正确的表述

A. a反应的离子方程式可能是:2Fe2+ +4Br-+3Cl2 =2Fe3+ +2Br2 +6Cl-
B. b反应中产生无色无味气体,说明HClO的酸性强于H2CO3
C. c反应的现象中知可以直接利用硝酸银溶液检验Cl-
D. d反应的最终现象是紫色石蕊溶液褪色,因为Cl2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关烷烃的叙述中,不正确的是
A. 在烷烃分子中,所有的化学键都为单键
B. 所有的烷烃在光照条件下都能与氯气发生取代反应
C. 烷烃分子的通式为CnH2n+2,符合该通式的烃不一定是烷烃
D. 随着碳原子的增加,烷烃的熔、沸点逐渐升高。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g) +Cl2(g) ![]() COCl2(g) ;ΔH = a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ;ΔH = a kJ/mol反应过程中测定的部分数据如下表:
t/min | n(CO)/mol | n(Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应0~2min末的平均速率v(COCl2)=______mol/(L·min)。
②在2min~4min间,v正(Cl2) _________v逆(CO) (填“>”、“=”或“<”), 该温度下K = _____。
③ 已知X、L可分别代表温度或压强,下图表示L一定时,CO的 转化率随X的变化关系。

X代表的物理量是 __________;a_____ 0 (填“>”,“=”,“<”)。
(2)在催化剂作用下NO和CO转化为无毒气体: 2CO(g)+2NO(g) ![]() 2CO2(g)+N2 (g) ;ΔH=-748 kJ·mol-1
2CO2(g)+N2 (g) ;ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是 ________________ 。

②已知:测定空气中NO和CO 含量常用的方法有两种:方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为________________。方法2:氧化还原滴定法。用H2O2溶液吸收尾气、将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸依度。写出NO 与H2O2溶液反应的离子方程式:________________________________。
(3)NO2 会污染环境,可用Na2CO3 溶液吸收NO2 并生成CO2,已知9.2g NO2气体和Na2CO3 溶液完全反应时转移电子0.1mol,恰好反应后,使得溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中存在的所有离子浓度大小关系是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软质隐形眼镜材料W、树脂X的合成路线如图所示. 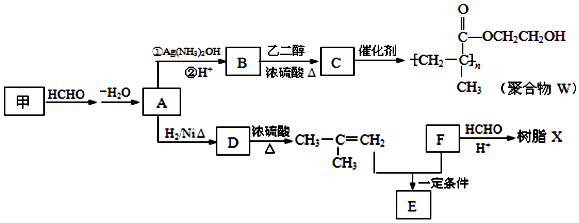
已知: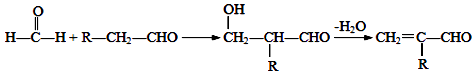
(1)A中含有的官能团的结构简式是 .
(2)甲的结构简式是 .
(3)B→C反应的化学方程式是 .
(4)B有多种同分异构体.属于酯且含有碳碳双键的同分异构体共有种(不考虑顺反异构.
(5)已知F的相对分子质量为110,1molF可与足量钠反应生成22.4L氢气(标准状况下),
苯环上的氢原子化学环境都相同.则F还能发生的反应是(填序号)
a.加成反应 b.氧化反应 c.加聚反应 d.水解反应
(6)写出树脂X可能的结构简式(写出一种即可).
(7)E的分子式为C10H14O2 , 含三个甲基,苯环上的一溴代物有两种,生成E的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性
B.水的离子积变大、pH变小、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积不变、pH不变、呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:在B槽中装有100mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.6amL。

(1)将A倒插入B水槽中发生的反应为________________________________ ,该反应中氧化剂与还原剂的质量比为__________ ,原混合气体中NO2和NO的物质的量之比为________.
(2)通过导气管C往余下气体的试管A中缓慢持续通入氧气,A中可能观察到的现象是: __________.
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为_________ (设溶液的体积仍为100mL)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com