
【题目】下列关于溶液的叙述中不正确的是
A. 等pH的盐酸与醋酸稀释后pH的变化如下图所示,则曲线II表示的是醋酸的稀释图象

B. 溶有等物质的量的NaCN、NaHCO3的溶液中:c(HCN)+C(CN-)=c(HCO3-)+c(H2CO3)+c(CO32-)
C. 25℃时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的溶溶液体积液等体积混合后pH=4:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
D. 已知某温度下Ksp(CH3COOAg)=2.8×10-3,浓度均为0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀
【答案】D
【解析】A. 稀释促进弱酸醋酸的电离,所以醋酸pH变化较慢,则曲线II表示的是醋酸的稀释图象,故A正确;B. 溶有等物质的量的NaCN、NaHCO3的溶液中:CN-+ H2O![]() HCN+OH-,
HCN+OH-,![]()
![]() H+ +
H+ +![]() ,
, ![]() +H2O
+H2O![]() H2CO3+OH-,元素守恒:c(HCN)+C(CN-)=c(HCO3-)+c(H2CO3)+c(CO32-),故B正确;C. 25℃时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的溶溶液体积液等体积混合后pH=4,表明CH3COOH的电离程度大于CH3COONa的水解程度,所以c(CH3COO-)>c(Na+)>c(CH3COOH),电荷守恒:c(CH3COO-)+c(OH-)= c(Na+)+c(H+),因此,c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故C正确;D. c(Ag+)=c(CH3COO-)=0.05mol·L-1,c(CH3COO-)c(Ag+)=2.5×10-3<Ksp(CH3COOAg)=2.8×10-3,不能产生CH3COOAg沉淀,故D不正确。故选D。
H2CO3+OH-,元素守恒:c(HCN)+C(CN-)=c(HCO3-)+c(H2CO3)+c(CO32-),故B正确;C. 25℃时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的溶溶液体积液等体积混合后pH=4,表明CH3COOH的电离程度大于CH3COONa的水解程度,所以c(CH3COO-)>c(Na+)>c(CH3COOH),电荷守恒:c(CH3COO-)+c(OH-)= c(Na+)+c(H+),因此,c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故C正确;D. c(Ag+)=c(CH3COO-)=0.05mol·L-1,c(CH3COO-)c(Ag+)=2.5×10-3<Ksp(CH3COOAg)=2.8×10-3,不能产生CH3COOAg沉淀,故D不正确。故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,导致浓度偏高的原因可能是 ( )
A. 容量瓶盛过NaOH溶液,使用前未洗涤 B. 定容时仰视刻度线
C. 容量瓶中原有少量的蒸馏水 D. 移液时,不慎将液体流到瓶外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇和乙酸是生活中两种常见的有机物.下列说法正确的是( )
A.乙醇、乙酸都能与金属钠反应
B.乙醇、乙酸都能与NaOH溶液反应
C.乙醇、乙酸都能使紫色石蕊试液变红色
D.乙醇、乙酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。工业上可通过以下反应制得ClO2:2NaClO3+Na2SO3+H2SO4= 2ClO2↑+2Na2SO4 + H2O。下列说法正确的是
A.氯元素的化合价升高 B.Na2SO3是还原剂
C.NaClO3发生氧化反应 D.H2SO4被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol有机物A(分子式为C6H10O4)经水解得1mol B和2mol C,C经分子内脱水得D,D可发生加聚反应生成 ![]() ,由此可知A为( )
,由此可知A为( )
A.HOOC(CH2)4COOH
B.HOOC(CH2)3COOCH3
C.CH3COO(CH2)2COOCH3
D.CH3CH2OOC﹣COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种橡胶的分解产物为碳氢化合物,对这种碳氢化合物作如下实验:①若取一定量完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72g,再通过石灰水,石灰水增重2.2g.②经测定,该碳氢化合物(气体)的密度是相同条件下氢气密度的34倍.③该碳氢化合物0.1mol能和32g溴起加成反应.④经分析,在③的生成物中,溴原子分布在不同的碳原子上,且溴代物中有一个碳原子在支链上.下列说法正确的是( )
A.该碳氢化合物为2﹣甲基﹣1,3﹣戊二烯
B.该碳氢化合物与溴单质1:1加成时可以生成3种不同的产物
C.该碳氢化合物与溴单质1:1加成时可以生成2种不同的产物
D.该碳氢化合物与足量氢气加成时可以生成正戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是
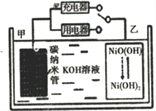
A. 充电时,电池的碳电极与直流电源的正极相连
B. 放电时,甲电极为负极,电极反应为: H2-2e═2H+
C. 充电时,乙电极反应式为:NiO(OH)+H2O+e═Ni(OH)2+OH
D. 电池总反应为H2+2NiO(OH)![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com