
【题目】以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐,某工厂运用该原理生产铜和绿矾(FeSO4的晶体,含结晶水)。
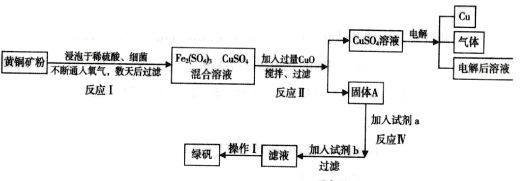
回答下列问题:
(1)写出反应Ⅰ的化学反应方程式:__________________________;
(2)反应II中CuO的作用是_________________________;
(3)写出加入试剂b发生的反应离子方程式_________________________________________;
(4)欲从溶液中获得绿矾晶体,分离操作I应为___________________________;
(5)生产过程中,可循环使用的物质有__________________(写化学式)。
【答案】 4CuFeS2+2H2SO4+17O2=2Fe2(SO4)3+4CuSO4+2H2O 调节溶液的pH使Fe3+转化为Fe(OH)3沉降除去 Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+ 蒸发浓缩,降温结晶,过滤 O2 H2SO4
【解析】运用湿法炼铜的同时制绿矾(FeSO47H2O)的工艺:将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)浸泡于稀硫酸细菌,通入氧气,数天后过滤,得到氧化成含Fe3+,Cu2+的溶液,加入过量CuO,促进铁离子水解生成氢氧化铁沉淀与铜离子分离,过滤得到固体A为氢氧化铁和过量的氧化铜,溶液为硫酸铜溶液,硫酸铜溶液电解生成铜、氧气和硫酸;氢氧化铁中加入试剂a为稀硫酸,用稀硫酸溶解,再用试剂b为铁粉还原可得滤液为硫酸亚铁溶液,再通过蒸发浓缩、隔绝降温结晶、过滤、洗涤、干燥得绿矾。
(1)反应Ⅰ中的反应物是CuFeS2、O2、H2SO4三种物质,生成物是硫酸铁、硫酸铜和水,根据奇偶法配平,所以方程式是:4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O;故答案为: 4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O;
(2)加入过量氧化铜调节溶液pH,使铁离子变成氢氧化铁沉淀,故答案为:调节混合溶液的pH,使Fe3+转化为Fe(OH)3沉降除去;
(3)试剂b为铁粉,发生反应的离子方程式为Fe+Cu2+=Fe2++Cu、Fe+2Fe3+=3Fe2+,故答案为:Fe+Cu2+=Fe2++Cu、Fe+2Fe3+=3Fe2+;
(4)获得的滤液经过蒸发浓缩、冷却结晶、过滤,最后得到绿矾,故答案为:蒸发浓缩,冷却结晶,过滤;
(5)根据流程图,可循环使用的物质有O2、H2SO4,故答案为:O2、H2SO4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性
B.水的离子积变大、pH变小、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积不变、pH不变、呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:在B槽中装有100mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.6amL。

(1)将A倒插入B水槽中发生的反应为________________________________ ,该反应中氧化剂与还原剂的质量比为__________ ,原混合气体中NO2和NO的物质的量之比为________.
(2)通过导气管C往余下气体的试管A中缓慢持续通入氧气,A中可能观察到的现象是: __________.
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为_________ (设溶液的体积仍为100mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的且符合操作要求的是
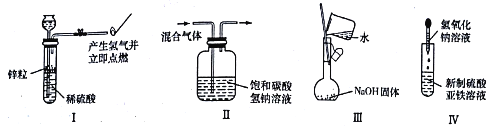
A. I可用于制备并检验氢气的可燃性
B. II可用于除去CO2中的HCl
C. 用Ⅲ来配制一定物质的量浓度的NaOH溶液
D. 用IV中操作制备氢氧化亚铁并观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实与原子结构模型建立的关系正确的是
A.阴极射线实验发现电子:道尔顿原子结构模型
B.α粒子散射实验发现原子核:卢瑟福原子结构模型
C.氢原子光谱发现电子分层排布:卢瑟福原子结构模型
D.α粒子散射实验发现电子:汤姆生原子结构模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg。那么一个铅笔字含有的碳原子数约为( )
A. 2.5×1019个 B. 2.5×1022个 C. 5×1019个 D. 5×1022个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容时,NO2和N2O4之间发生反应N2O4(g)2NO2(g),如图所示. 
(1)曲线(填“X”或“Y”)表示N2O4的物质的量随时间变化的曲线.
(2)若降低温度,则v(正) , v(逆) . (填“加快”或“减慢”)
(3)若加入N2O4 , 则v(正) , v(逆) . (填“加快”或“减慢”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的钠和铝的混合物与足量的水充分反应,没有金属剩余,收到2.24L气体,下列说法一定正确的是
A. 所得气体为氢气 B. 所得气体的物质的量为 0.1 mol
C. 上述过程只发生一个化学反应 D. 所得溶液中只有一种溶质
【答案】A
【解析】钠与水反应生成氢气,铝与氢氧化钠溶液反应生成氢气,所以所得气体为氢气,故A正确;非标准状况下,2.24L气体的物质的量不一定是 0.1 mol,故B错误;上述过程,发生钠与水反应生、铝与氢氧化钠溶液反应,共发生两个化学反应,故C错误;所得溶液中的溶质可能有偏铝酸钠和氢氧化钠两种溶质,故D错误。
点睛:铝能与酸反应放出氢气,铝也能与强碱溶液反应放出氢气,如![]() 。
。
【题型】单选题
【结束】
21
【题目】I.SO2是一种重要的化工原料,其合理利用以及废气处理一直是化工研究的热点。
(1)氧元素在元素周期表中位于第______周期______族,硫原子核外有_____种能量不同的电子。
(2)元素的非金属性S比O______(填“强”或“弱”),从原子结构的角度解释原因:__________。
II.工业上利用反应SO2 + MnO2 → MnSO4 可以制备高纯 MnSO4,实验装置如下图:

(3)请标出反应SO2 + MnO2 → MnSO4的电子转移方向和数目____________
(4)在通入干燥空气的条件下,一段时间后,测得反应后溶液中的 n(SO42-)明显大于 n(Mn2+),请说明原因: ___________________。用化学方程式表示石灰乳的作用: ___________________。
III.SO2可用于处理含 Cr2O72-(铬元素化合价为+6)的废水,最后转化为铬沉淀(铬元素化合价为+3)除去。一种处理流程如下:
![]()
(5)NaHSO3与 Cr2O72-反应时,物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( ) 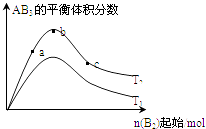
A.反应速率a>b>c
B.若T2>T1 , 则正反应一定是吸热反应
C.达到平衡时,AB3的物质的量大小为:b>c>a
D.达到平衡时A2的转化率大小为:b>a>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com