
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+8NH3  7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH=—196.6 kJ/mol ;
2SO3(g) ΔH=—196.6 kJ/mol ;
2NO(g)+O2(g)  2NO2(g) ΔH=—113.0 kJ/mol ;
2NO2(g) ΔH=—113.0 kJ/mol ;
①则反应NO2(g)+SO2(g)  SO3(g)+NO(g) 的ΔH=________ kJ/mol。
SO3(g)+NO(g) 的ΔH=________ kJ/mol。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___ _____。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=__ _。
(3)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式: ;该反应中氧化产物与还原产物的物质的量之比为 。
(4)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,易引起爆炸。为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为 。
(1)3NO2+H2O=2HNO3+NO 6.72
(2)①-41.8 ②B ③2.67或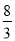
(3)4NH3+6NO 5N2+6H2O ; 2:3
5N2+6H2O ; 2:3
(4)3Cl2 + 2NH4++ 8OH- → N2↑ + 6Cl- + 8H2O。
【解析】
试题分析:(1)二氧化氮与水反应生成硝酸和NO,化学方程式是3NO2+H2O=2HNO3+NO;利用反应6NO2+8NH3 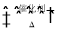 7N2+12H2O也可处理NO2。该反应中+4价N原子降低到0价,得到4个电子,整体得到24个电子,每有6mol二氧化氮参加反应,则转移24mol电子,所以当转移1.2 mol电子时,有6mol×1.2/24=0.3mol,标准状况下的体积是0.3mol×22.4L/mol=6.72L;
7N2+12H2O也可处理NO2。该反应中+4价N原子降低到0价,得到4个电子,整体得到24个电子,每有6mol二氧化氮参加反应,则转移24mol电子,所以当转移1.2 mol电子时,有6mol×1.2/24=0.3mol,标准状况下的体积是0.3mol×22.4L/mol=6.72L;
(2)①根据盖斯定律,将第一个热化学方程式减去第二个热化学方程式可得2NO2(g)+2SO2(g)  2SO3(g)+2NO(g) 的ΔH=(—196.6 kJ/mol)-(—113.0 kJ/mol)=-83.6kJ/mol,所以反应NO2(g)+SO2(g)
2SO3(g)+2NO(g) 的ΔH=(—196.6 kJ/mol)-(—113.0 kJ/mol)=-83.6kJ/mol,所以反应NO2(g)+SO2(g)  SO3(g)+NO(g) 的ΔH=-83.6kJ/mol/2=-41.8kJ/mol;
SO3(g)+NO(g) 的ΔH=-83.6kJ/mol/2=-41.8kJ/mol;
②A.该反应是气体压强不变的可逆反应,所以体系压强保持不变 时不一定是平衡状态,错误; B.因为二氧化氮为红棕色,反应开始后颜色逐渐变浅,当混合气体颜色保持不变时,反应达到平衡状态,正确;C.SO3和NO都是生成物,体积之比始终是1:1,所以SO3和NO的体积比保持不变的状态不是平衡状态,错误;D.每消耗1 mol SO3的同时生成1 mol NO2,表示的都是逆反应速率,不能判断平衡状态,错误,答案选B。
③测得上述反应平衡时NO2与SO2的体积比为1∶6,且该反应是气体物质的量不变的可逆反应,设开始时,二氧化氮的物质的量是1mol,二氧化硫的物质的量是2mol,反应中二氧化氮物质的量减少xmol,则二氧化硫的物质的量也减少xmol,生成三氧化硫和NO的物质的量都是xmol,则(1-x):(2-x)=1:6,解得x=0.8,所以该反应的平衡常数可用物质的量来计算,K=0.82/(1-0.8)(2-0.8)=8/3;
(3)NH3可用来消除NO的污染,生成两种对环境无害的物质,根据元素构成判断,生成物是氮气和水,所以反应的化学方程式是4NH3+6NO 5N2+6H2O ;反应中-3价N被氧化为0价N,+2价N原子被还原为0价N原子,则氧化产物是氨气被氧化得到的氮气,还原产物是NO被还原得到的氮气,所以氧化产物与还原产物之比为氨气与NO的物质的量之比是4:6=2:3;
5N2+6H2O ;反应中-3价N被氧化为0价N,+2价N原子被还原为0价N原子,则氧化产物是氨气被氧化得到的氮气,还原产物是NO被还原得到的氮气,所以氧化产物与还原产物之比为氨气与NO的物质的量之比是4:6=2:3;
(4)根据题意,氯气与铵根离子,在碱性条件下反应生成氯离子和氮气,根据元素守恒,则产物中有水生成,所以离子方程式是3Cl2 + 2NH4++ 8OH- → N2↑ + 6Cl- + 8H2O。
考点:考查化学平衡状态的判断,平衡常数的计算,盖斯定律的应用,二氧化氮的化学性质,氧化还原反应的分析,方程式的书写


科目:高中化学 来源:2014-2015学年山东省莱芜市高三1月月考化学试卷(解析版) 题型:选择题
关于下列各装置图的叙述中,正确的是

A.装置①阳极有红色物质析出
B.装置②的总反应为Cu+2Fe3+=Cu2++2Fe2+
C.装置③中a为负极,发生的电极反应式为H2+2OH-—2e-=2H2O
D.用装置④精炼铜,则a极为纯铜,电解质溶液可为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考理综化学试卷(解析版) 题型:填空题
(12分)【化学——化学与技术】
化工厂的设计是将实验室的研究成果转化为工业化生产的重要的基础工作。
(1)以硫铁矿为原料生产硫酸需经过 、 和 三个主要生产阶段。
(2)侯氏制碱法是在索尔维制碱法的基础上创造出的一种新的制造纯碱的方法。具体工艺流程图如下:

①索尔维制碱法的原理是 。(用化学方程式表示)
②侯氏制碱法与索尔维制碱法相比,优点是 。
③侯氏制碱法可以循环使用的物质有 。
(3)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素。下列说法中,错误的是

A.X元素最高价氧化物对应水化物的酸性弱于Y元素的
B.Y元素气态氢化物的稳定性大于Z元素的
C.M和Y两种元素,可以形成电子层结构相同的两种简单离子
D.M元素的氧化物既可以与酸溶液反应,也可以与碱溶液反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三1月月考化学试卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是
A.浓硫酸有吸水性,可用于干燥氨气和二氧化硫
B.明矾溶于水能形成胶体,可用于自来水的杀菌消毒
C.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
D.金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三1月月考化学试卷(解析版) 题型:选择题
下列各反应的离子方程式中,正确的是
A.铜投入硝酸银溶液中:Cu+Ag+=Cu2++Ag
B.硫酸铝溶液中加入过量的氨水:Al3++3 OH-===Al(OH)3↓
C.铁片放入过量的稀硝酸中:3Fe+8H++2NO3-===3Fe2++2NO↑+4H2O
D.将铝片放入过量NaOH溶液中:2Al+2OH-+6H2O===2Al(OH)4-+3H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高二上学期期末化学试卷(解析版) 题型:选择题
下图甲和乙是双液原电池装置。由图可判断下列说法错误的是

A.甲图电池反应的离子方程式为:Cd(s)+Co2+(aq)===Co(s)+Cd2+(aq)
B.2Ag(s)+Cd2+(aq)===Cd(s)+2Ag+(aq)反应能够发生
C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D.乙图当有1 mol电子通过外电路时,正极有108 g Ag析出
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏徐州市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列变化过程中,没有发生化学变化的是
A.用蒸馏法淡化海水 B.从海带中提取碘
C.石墨转化为金刚石 D.氨气溶解在水中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com