
关于下列各装置图的叙述中,正确的是

A.装置①阳极有红色物质析出
B.装置②的总反应为Cu+2Fe3+=Cu2++2Fe2+
C.装置③中a为负极,发生的电极反应式为H2+2OH-—2e-=2H2O
D.用装置④精炼铜,则a极为纯铜,电解质溶液可为CuSO4溶液
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:填空题
(6分)某固体混合物可能由KCl、Na2SO4、KI、CuCl2、CaCl2和Na2CO3中的一种或几种组成。依次进行下列实验:
①混合物加水得无色透明溶液;
②向上述溶液中加入过量BaCl2溶液有白色沉淀生成,将沉淀滤出;
③上述白色沉淀可部分溶于稀盐酸;
④往上述滤液中加入AgNO3溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解。根据以上实验推断:混合物中肯定含有 ;
肯定没有 ;
可能含有 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三1月月考理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使紫色石蕊试剂显红色的溶液:NH4+、K+、[Al(OH)4]-、NO3-
B.稀HNO3溶液: Na+、Mg2+、SO42-、Cl-
C.FeCl3溶液:K+、Na+、I-、SO42-
D.由水电离产生的c(H+)=10-13 mol·L-1的溶液:K+、Na+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:选择题
利用下列实验装置进行的相应实验,不能达到实验目的的是

A.图1所示装置可制取氨气
B.图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液
C.图3所示装置可制备Fe(OH)2并容易观察到白色沉淀
D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂自性、还原性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省莱芜市高三1月月考化学试卷(解析版) 题型:填空题
(13分)实验室以含有少量铁的粗铜粉和硫酸与硝酸的混合溶液为原料制备CuSO4·5H2O(胆矾)晶体。设计的工艺流程图如下:

请回答下列问题:
(1)根据反应原理,操作①所需的混酸溶液中硝酸和硫酸的理论配比(物质的量之比)为________。操作②中需要把NO与_____气体混合通入水中,混入该气体的目的是__________________________(用化学方程式表示)。
(2)溶液I中存在一定浓度的Fe3+、Cu2+,在该浓度时生成氢氧化物沉淀的pH如下表。操作③中某学生设计物质X为H2O,若加水调整溶液pH,则Fe(OH)3开始沉淀的pH_______1.9(填“<”、“>”或“=”);而实际操作中一般不用此法调节溶液pH,其主要原因是___________________。

(3)操作④中物质Y为_______。查阅资料知CuSO4·5H2O的溶解度曲线如图所示,则操作⑤应采取的措施是蒸发浓缩、______________、过滤、洗涤、干燥等。

(4)为测定胆矾中结晶水的数目,称取25.0g胆矾品体在坩埚中加热,固体质量随温度升高而变化的曲线如图。
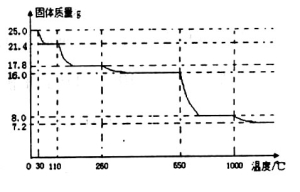
当固体质量为8.0g时,观察到固体完全呈黑色。请列式计算开始称取的胆矾中结晶水的数目。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省莱芜市高三1月月考化学试卷(解析版) 题型:选择题
海水是一个巨大的化学资源库,下列有关海水综合利用的说法错误的是
A.海水中含有溴元素,需经过化学变化才可以得到溴单质
B.无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能
C.从海水中可以得到NaCl,电解熔融NaCl可制备金属钠
D.从海水中提取镁可以采用下列方法:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省莱芜市高三1月月考化学试卷(解析版) 题型:选择题
下列物质中的杂质(括号内为杂质),不能用在空气中加热的方法除去的是
A.Na2O2(Na2O) B.KCl(KClO3)
C.Na2CO3(NaHCO3) D.NH4Cl(I2)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三1月月考化学试卷(解析版) 题型:填空题
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+8NH3  7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH=—196.6 kJ/mol ;
2SO3(g) ΔH=—196.6 kJ/mol ;
2NO(g)+O2(g)  2NO2(g) ΔH=—113.0 kJ/mol ;
2NO2(g) ΔH=—113.0 kJ/mol ;
①则反应NO2(g)+SO2(g)  SO3(g)+NO(g) 的ΔH=________ kJ/mol。
SO3(g)+NO(g) 的ΔH=________ kJ/mol。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___ _____。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=__ _。
(3)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式: ;该反应中氧化产物与还原产物的物质的量之比为 。
(4)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,易引起爆炸。为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高二上学期期末化学试卷(解析版) 题型:选择题
有关键能(破坏1 mol共价键吸收的能量)数据如表
化学键 | Si—O | O===O | Si—Si |
键能/kJ·mol-1 | X | 498.8 | 176 |
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)===SiO2(s) ΔH=-989.2 kJ·mol-1,则X的值为(已知1 mol Si中含有2 mol Si—Si键,1 mol SiO2中含有4 mol Si—O键)
A.423.3 B.460 C.832 D.920
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com