
【题目】NA代表阿伏加德罗常数的值,下列有关叙述不正确的是( )
A.在熔融状态下,1molNa2O2完全电离出的离子数目为3NA
B.将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数m NA/14
C.在标准状况下,22.4LCH4与18 gH2O所含有的电子数均为10NA
D.含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为 NA
【答案】B
【解析】
A.Na2O2在熔融状态下电离出2个钠离子和1个过氧根,故1mol过氧化钠能电离出3mol离子即3NA个,故A正确;
B.将CO2通过Na2O2使固体质量增加mg,固体增加的质量相当于CO的质量,则参加反应二氧化碳的物质的量为![]() mol,1mol二氧化碳与过氧化钠反应转移1mol电子,故反应中转移的电子数=
mol,1mol二氧化碳与过氧化钠反应转移1mol电子,故反应中转移的电子数= ![]() ,故B错误;
,故B错误;
C.标况下,22.4L甲烷的物质的量是1mol,含有10mol电子,18g水物质的量是1mol,含有10mol电子,所含有的电子数均为10NA,故C正确;
D.加入一定量的氨水后,溶液呈中性,n(H+)=n(OH-),据溶液中的电荷守恒:n(Cl-)+n(OH-)=n(NH4+)+n(H+),所以n(Cl-)=n(NH4+)=1mol,即铵根离子为NA个,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】下列反应能用勒夏特列原理解释的是
A. 加入催化剂有利于氨的合成
B. 煅烧粉碎的黄铁矿矿石有利于SO2的生成
C. 硫酸生产中用98%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带具有从海水中富集碘的能力,下面是某化学实验小组在实验室中以海带为原料提取碘单质的流程:![]()

试回答:
(1)指出提取碘的过程中有关的实验操作名称:①_________,⑤___________。
(2)步骤③中用到的玻璃仪器有烧杯、_____________和_________。
(3)若海带中的碘以碘化钠形式存在,写出步骤④中发生反应的化学方程式并用双线桥法表示该反应电子转移的方向与数目_____________________________________。
(4)操作⑤中所用的有机试剂可以是_________(填字母代号)
A.乙醇 B.苯 C.四氯化碳 D.NaOH溶液
(5)步骤⑥的操作是分液,分液时要将分液漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,此操作的目的是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气。
I.工业上通常采用电解法制氯气:观察下图,回答:
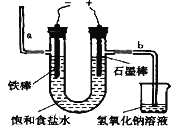
(1)通电后,_____(填“铁棒”或“石墨棒”)电极上产生氯气,若饱和食盐水中含有酚酞,______(填“a”或“b”)侧先变红。
(2)写出该电解反应的化学方程式为_______________________________________。
(3)该装置中,NaOH溶液的作用是____________________________。
II.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:

(1)连接上述仪器的正确顺序是:E→_______→________→_______→_______→H→G→F。
(2)气体发生装置中进行的反应化学方程式是________________________________;若在标准状态下收集到4.48 L氯气,则被氧化的HCl的物质的量是_______mol。
(3)上面装置中饱和食盐水的作用是__________________。
(4)将新制氯水滴到pH试纸上,现象为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
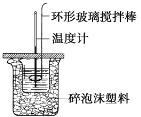
(1)使盐酸与NaOH溶液混合均匀的正确操作是___(填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动。
(2)倒入NaOH溶液的正确操作是_____(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)为什么所用NaOH溶液要稍过量?________。
(4)现将一定量的稀氢氧化钠溶液、浓氢氧化钙溶液、稀氨水分别和1 L 1 mol·L1的稀盐酸恰好完全反应,其热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的大小关系为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量; ②增加CO的量;
③将容器的体积缩小一半; ④保持体积不变,充入N2以增大压强;
⑤升高反应体系的温度; ⑥保持压强不变,充入N2以增大体积。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为达到预期的实验目的,下列操作中正确的有( )
①配制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再用水稀释到所需的浓度
②用10 mL的量筒量取4.80 mL的浓硫酸
③蒸发溶液时,边加热边搅拌,直至蒸发皿中的液体蒸干
④向无色溶液中加入BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO![]()
⑤为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
⑥中和热测定的实验中使用的玻璃仪器只有2种
⑦实验室可利用浓氨水和碱石灰混合的方法制取少量氨气
⑧除去NO中混有的NO2气体可通过水洗,再干燥后用向上排空气法收集
A. 5项 B. 4项
C. 3项 D. 2项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入amol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/bmolL﹣1 B. 2a/bmolL﹣1 C. 3a/bmolL﹣1 D. 5a/bmolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)的无毒与不致癌性有很多特殊用途,其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如下:

回答下列问题:
(1)Bi位于元素周期表第六周期,与N、P同族,Bi的原子结构示意图为________。
(2)“浸出”时Bi2S3与FeCl3溶液反应的化学方程式为________,反应液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是________(用离子方程式表示)。

(3)“置换”时生成单质铋的离子方程式为________。“母液1”中通入气体X后可循环利用,气体X的化学式为________。
(4)“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,其装置示意图如右。电解后,阳极底部留下的为精铋。写出电极反应式:阳极________;阴极________。
(5)碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是________。“母液2”中可回收的主要物质是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com