
【题目】利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
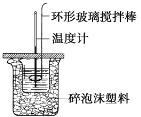
(1)使盐酸与NaOH溶液混合均匀的正确操作是___(填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动。
(2)倒入NaOH溶液的正确操作是_____(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)为什么所用NaOH溶液要稍过量?________。
(4)现将一定量的稀氢氧化钠溶液、浓氢氧化钙溶液、稀氨水分别和1 L 1 mol·L1的稀盐酸恰好完全反应,其热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的大小关系为_______。
【答案】D C 确保盐酸被完全中和 Q2>Q1>Q3
【解析】
(1)盐酸和氢氧化钠混合时,用套在温度计上的环形玻璃搅拌棒轻轻地搅动,使盐酸与NaOH溶液混合均匀;
(2)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(3)为了确保定量的盐酸反应充分,所用NaOH稍过量;
(4)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,弱电解质存在电离平衡,电离过程是吸热过程,据此分析作答;
(1) 使盐酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;
故答案为:D;
(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故答案为:C;
(3) 实验中,所用NaOH稍过量的原因是确保定量的盐酸反应完全,
故答案为:确保盐酸被完全中和;
(4)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,一定量的稀氢氧化钠溶液、1 L 1molL1的稀盐酸恰好完全反应放热为57.3kJ; 浓氢氧化钙溶液溶于水放出部分热量,则1 L 1 mol·L1的稀盐酸恰好完全反应放热大于57.3kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和1 L 1molL1的稀盐酸恰好完全反应放热小于57.3kJ,故Q2>Q1>Q3。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置。请回答:
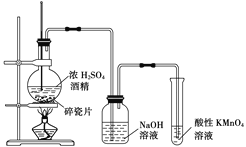
甲 乙
(1)实验步骤:
①组装仪器,检验装置的______;
②在各装置中注入相应的试剂(如图所示);
③加热,使温度迅速升到______℃;实验时烧瓶中液体混合物逐渐变黑。
(2)能够说明乙烯具有还原性的现象是:___________________________________;装置甲的作用是:____________________。若无甲装置,是否也能检验乙烯具有还原性?____,理由是:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品添加剂必须严格按照食品安全国家标准的规定使用。作为食品添加剂中的防腐剂G可经下列反应路线得到(部分反应条件略)。则下列说法不正确的是()
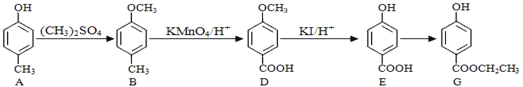
A.A与苯酚在分子组成上相差一个![]() 原子团,它们互为同系物
原子团,它们互为同系物
B.常温下A和浓溴水发生加成反应
C.经反应![]() 和
和![]() 保护的官能团是羟基
保护的官能团是羟基
D.1molE物质最多可与2molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+![]() O2(g)
O2(g)![]() H2O(g),反应过程中能量变化如图所示,请回答下列问题。
H2O(g),反应过程中能量变化如图所示,请回答下列问题。
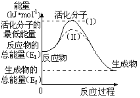
(1)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能_____,单位体积内活化分子的百分数__,因此反应速率____,(前面的三个空填“增大”“减小”“不变”)你认为最可能的原因是_______。
(2)在一固定容积的密闭容器中,进行如下反应:CsH2Og![]() COgH2g。若容积体积为2L,反应10s H2质量增加0.4g,则该时间内CO的反应速率为___。若增加炭的量,则正反应速率____(选填“增大”、“减小”、“不变”)。若增大压强,化学平衡向_____移动(选填“正向”、“逆向”或“不”)。
COgH2g。若容积体积为2L,反应10s H2质量增加0.4g,则该时间内CO的反应速率为___。若增加炭的量,则正反应速率____(选填“增大”、“减小”、“不变”)。若增大压强,化学平衡向_____移动(选填“正向”、“逆向”或“不”)。
(3)若降低温度,平衡逆向移动,则正反应是______反应(选填“吸热”或“放热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列有关叙述不正确的是( )
A.在熔融状态下,1molNa2O2完全电离出的离子数目为3NA
B.将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数m NA/14
C.在标准状况下,22.4LCH4与18 gH2O所含有的电子数均为10NA
D.含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下恒容容器中,可逆反应![]() 达到平衡状态的标志是
达到平衡状态的标志是
①单位时间内生成n mol H2的同时生成2n mol HI
②单位时间内生成n mol H2的同时,生成n molI2
③用HI、I2、H2的物质的量浓度变化表示的反应速率的比为2∶1∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的压强不再改变的状态
A.①④ .B.①④⑤ .C.①②④⑤ .D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:![]()
B.含有AgCl和AgI固体的悬浊液:![]()
C.pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中:![]() 大小顺序:①>②>③
大小顺序:①>②>③
D.含等物质的量的NaHC2O4和Na2C2O4的溶液(H2C2O4为二元弱酸):![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和氯气,用光照射烧瓶一段时间,下列说法正确的是( )
![]()
A. 只能生成CH3Cl一种有机物
B. 烧瓶内液面不可能上升
C. 大试管内的液体可能会分层
D. 向水中加入石蕊试液后不变色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com