
【题目】有X、Y、Z三种短周期元素,已知X原子L层电子比M层电子多2个, Y3+离子电子层结构与Ne相同;Z与X处于同一周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出元素X名称:________ ;
(2)写出Y元素在元素周期表的位置_______________ ;
(3)画出元素Z的原子结构示意图:___________________ ;
(4)Z元素所在主族的元素形成的含氧酸酸性最强的是(写化学式)____________;
(5)X的氢化物的电子式为______________;
(6)写出Y单质与氢氧化钠溶液反应化学方程式_________________;
(7)标准状况下,2.24LZ单质与足量氢氧化钙完全反应时,电子转移总数为_____mol。
【答案】硫 第3周期第ⅢA族 ![]() HClO4
HClO4 ![]()
![]() 0.1
0.1
【解析】
已知X原子L层电子比M层电子多2个,则X为S;Y3+离子电子层结构与Ne相同,则Y为Al;Z与X处于同一周期,其气态单质是双原子分子,两原子共用1对电子,则Z为Cl,以此答题。
经分析,X为S,Y为Al,Z为Cl;
(1)元素X名称为硫;
(2)Y元素在元素周期表的位置第3周期第ⅢA族;
(3)元素Z的原子结构示意图为:![]() ;
;
(4)Z元素所在主族的元素形成的含氧酸酸性最强的是HClO4;
(5)X的氢化物为H2S其电子式为:![]() ;
;
(6)Y单质与氢氧化钠溶液反应化学方程式:![]() ;
;
(7)标准状况下,2.24L Z单质与足量氢氧化钙完全反应:![]() ,电子转移总数
,电子转移总数![]() 。
。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】(1)Fe3+的电子排布式是_____________________________________________
(2)下列物质中既有离子键又有共价键的是________。
A.MgO B.NaOH C.CaCl2 D.CO2
(3) 关于下列分子的说法不正确的是________。
A.既有σ键又有π键
B.O—H键的极性强于C—H键的极性
C.是极性分子
D.该物质的分子之间不能形成氢键,但它可以与水分子形成氢键
(4)下列说法正确的是________。
A.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
B.NH3和CH4的空间构型相似
C.BF3与![]() 都是平面型分子
都是平面型分子
D.CO2和H2O都是直线型分子
(5)下列有关性质的比较,正确的是________。
A.第一电离能:O>N
B.水溶性:CH3CH2OH>CH3OCH3
C.沸点:H2S>H2O
D.晶格能:NaCl>MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫(SO2)是一种在空间地理、环境科学、地质勘探等领域受到广泛研究的一种气体。
Ⅰ.某研究小组设计了一套制备及检验SO2部分性质的装置,如图所示:
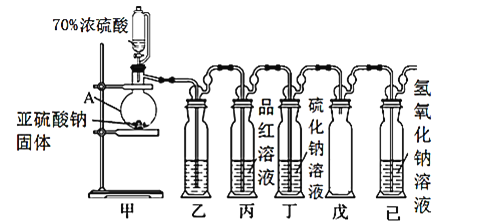
(1)仪器A的名称____________。
(2)装置乙的作用是为了观察生成SO2的速率,则装置乙中加入的试剂是____________。
(3)①实验前有同学提出质疑:该装置没有排空气,而空气中的O2氧化性强于SO2,因此装置丁中即使有浑浊现象也不能说明是SO2导致的。请你写出O2与Na2S溶液反应的化学反应方程式____________。
②为进一步检验装置丁产生浑浊现象的原因,进行新的实验探究。实验操作及现象见表:
序号 | 实验操作 | 实验现象 |
1 | 向10 mL 1 mol/L Na2S溶液中通O2 | 15 min后,溶液才出现浑浊 |
2 | 向10 mL 1 mol/L Na2S溶液中通SO2 | 溶液立即出现黄色浑浊 |
由实验现象可知:该实验条件下Na2S溶液出现浑浊现象是SO2导致的。你认为上表实验1反应较慢的原因可能是____________。
Ⅱ.铁矿石中硫元素的测定可以使用燃烧碘量法,其原理是以氮气为载体,以稀盐酸、淀粉和碘化钾的混合溶液为吸收液,用0.0010 mol·L-1KIO3标准溶液进行滴定。检测装置如图所示:
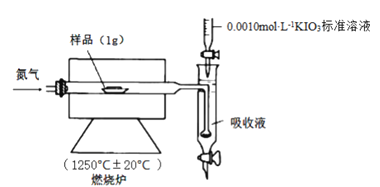
[查阅资料] ①实验进行5min样品中的S元素都可转化为SO2
②2IO3-+5SO2+4H2O=8H++5SO42-+I2
③I2+SO2+2H2O=2I-+SO42-+4H+
④IO3-+5I-+6H+=3I2+3H2O
(4)工业设定的滴定终点现象是____________。
(5)实验一:不放样品进行实验,5 min后测得消耗标准液体积为V1
实验二:加入1 g样品再进行实验,5 min后测得消耗标准液体积为V2
①比较数据发现V1远远小于V2,可忽略不计。则设置实验一的目的是___________。
②测得V2的体积如表:
序号 | 1 | 2 | 3 |
KIO3标准溶液体积/mL | 10.02 | 9.98 | 10.00 |
该份铁矿石样品中硫元素的质量百分含量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.14g乙烯和丁烯的混合物中含有的原子总数为3 NA
B.标准状况下,22.4L己烷中共价键数目为19 NA
C.7g C2H4中含有的氢原子数目为2 NA
D.1mol苯乙烯( ![]() )中含有的C=C数为4 NA
)中含有的C=C数为4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某有机物的分子式为C3H8O,红外光谱和核磁共振氢谱如下图, 氢谱三个峰的面积之比分别为1∶1∶6, 写出其结构简式_____________ (写一种)。


(2)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
①烃A的分子式为_____________。
②若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
③若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为_______________,_____________ ,______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2OH++Cl-+HClO
B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2=2C6H5OH+CO32-
D.实验室制备氢氧化铁胶体:Fe3++3H2O=Fe(OH)3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写方程式
(1)乙醛和新制Cu(OH)2悬浊液反应___
(2)苯酚溶液和浓溴水反应___
(3)3-氯戊烷和NaOH醇溶液共热___
(4)乙酸异丙酯与NaOH溶液反应___
(5) 的催化氧化___
的催化氧化___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A.实验室用溴水和苯在催化剂作用下制溴苯:![]() +Br2
+Br2![]()
![]() +HBr
+HBr
B.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH–![]() CH2BrCOO–+H2O
CH2BrCOO–+H2O
C.实验室制乙炔反应方程式:CaC2+2H2O→Ca(OH)2+C2H2↑
D.苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol·L-1的NaOH溶液分别滴定20.00mL均为0.1000mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法错误的是( )
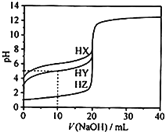
A.HZ是强酸,HX、HY是弱酸
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.向上述HY溶液中滴加任意NaOH溶液时,均存在c(H+)+c(Na+)=c(OH-)+c(Y-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com