
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)基态Fe原子有______个未成对电子,Fe3+的电子排布式为______。可用硫氰化钾检验Fe3+,形成的配合物的颜色为______。
(2)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。1mol乙醛分子中含有的键的数目为______。乙醛中碳原子的杂化轨道类型为______,乙酸的沸点明显高于乙醛,其主要原因是______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。
(3)Al单质为面心立方晶体,其晶胞边长a0.405nm,晶胞中铝原子的配位数为______。列式表示Al单质的密度______ gcm-3。(阿伏加德罗常数用NA表示)
【答案】4 3d5 血红色 6NA sp2和sp3 乙酸分子间存在氢键,而乙醛分子间不能形成氢键 16 12 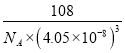
【解析】
根据基态原子的电子排布确定其未成对电子数及其离子的价电子排布;根据乙醛的分子结构确定其中σ键的数目及其碳原子的杂化方式 ;根据氢键对物质的溶解性的影响分析有机物的溶解性;根据晶胞结构和均摊法确定晶胞中的原子数;根据晶胞的质量和体积确定其密度。
(1)Fe是26号元素,基态Fe原子的价电子排布式为3d64s2,故其有4个未成对电子,其在化学反应中优先失去最外层电子,故Fe3+的电子排布式为[Ar] 3d5。实验室常用硫氰化钾检验Fe3+,形成的一系列配合物在水溶液中的的颜色为血红色。
(2)乙醛的结构简式为CH3CHO,分子中除C=O键是双键外,其余的均为σ键,双键中有一个是σ键,因此,1mol乙醛分子中含有的键的数目为6NA。乙醛中醛基中的碳原子形成3个σ键和一个π,故其杂化轨道类型为sp2,而甲基中的碳原子只形成4个,σ键,故该碳原子的杂化方式为sp3;乙酸的沸点明显高于乙醛,其主要原因是乙酸分子间存在氢键,而乙醛分子间不能形成氢键。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中占有氧原子的个数为4+8![]() ,所以,根据化学式Cu2O可知,该晶胞中有16个铜原子。
,所以,根据化学式Cu2O可知,该晶胞中有16个铜原子。
(3)Al单质为面心立方晶体,其晶胞边长a0.405nm,面心立方的金属原子的配位数均为12,故晶胞中铝原子的配位数为12。该晶胞中占有铝原子的数目为8![]() ,则晶胞的质量为
,则晶胞的质量为![]() ,晶胞的体积为
,晶胞的体积为![]() ,所以,Al单质的密度为
,所以,Al单质的密度为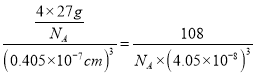 gcm-3。
gcm-3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列物质在指定条件下电离方程式正确的是( )
A. Na2CO3溶于水:Na2CO3===Na22++CO32-
B. Al(OH)3酸式电离:Al(OH)3===AlO2-+H2O+H+
C. NaHS溶于水HS-的电离:HS-+H2O![]() H2S+OH-
H2S+OH-
D. NaHSO4加热熔化:NaHSO4===Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法错误的是
A. 12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA
B. 5.8g熟石膏(2CaSO4 H2O)含有的结晶水分子数为0.02NA
C. 92.0g甘油(丙三醇)和甲苯的混合物中含氢原子数为8.0NA
D. 标准状况下,1L甲醛气体完全燃烧消耗O2分子个数约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、![]() 、
、![]()
B.c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、![]() 、
、![]()
C.0.1mol/LNH4HCO3溶液中:K+、Na+、![]() 、Cl-
、Cl-
D.0.1mol/LFeCl3溶液中:Na+、![]() 、S2-、
、S2-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.明矾和Ba(OH)2溶液反应至硫酸根沉淀完全的离子方程式:Al3++![]() +Ba2++3OH-=Al(OH)3↓+BaSO4↓
+Ba2++3OH-=Al(OH)3↓+BaSO4↓
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液通过量CO2制Al(OH)3:CO2+![]() +2H2O=Al(OH)3↓+
+2H2O=Al(OH)3↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,11.2 L SO2含有的氧原子数小于NA
B.0. 1 mol Na2O2和Na2O的混合物中含有的离子总数等于0.4NA
C.10 g质量分数为34%的H2O2溶液含有的氢原子数为0.2NA
D.100 mL 0.1 mol/L醋酸中含有的醋酸分子数是0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关说法正确的是(混合后溶液体积变化忽略不计)
A. 将pH=2的盐酸和pH=5的稀硫酸等体积混合,混合液的pH=3.5
B. 将pH=11的NaOH溶液和pH=13的Ba(OH)2溶液等体积混合,混合液的pH=12
C. 将pH=2的H2X溶液稀释至原来的1 000倍,得到混合溶液的pH=5
D. 将pH=1的盐酸和0.1 mol·L-1 的Ba(OH)2溶液等体积混合,混合液的pH=12.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有足量A的容积固定的密闭容器中加入B,发生反应:A(s)+2B(g) 4C(g)+D(g) ΔH<0。一定条件下达到平衡时,C的物质的量与加入的B的物质的量的关系如图所示。其他条件不变,下列措施能使θ值增大的是( )

A. 降低温度B. 增大压强C. 加入催化剂D. 再加入少量A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组通过测量溶液的电导率(电导率越大,说明溶液的导电能力越强)探究沉淀溶解平衡,各物质的电导率数据如下:
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
物质 |
固体 |
|
饱和溶液 |
饱和溶液 |
NaCl溶液 |
|
饱和溶液 |
电导率 | 0 | 7 | 37 | 389 | 1989 | 1138 | 13 |
下列分析不正确的是
A. ![]() 固体中不存在自由移动的离子
固体中不存在自由移动的离子
B. 与①、②对比,可说明③中![]() 发生了电离
发生了电离
C. ⑤、⑥等体积混合后过滤,推测滤液的电导率一定大于13
D. 将①中固体加入④中,发生反应:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com