
【题目】(1)某化工厂用氯气与石灰乳生产漂白粉,该厂出厂产品说明书如下:

①漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式:_____________________________;______________。
②某实验室研究员将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,收集到标准状况下448 mL气体,则该漂白粉中所含有效成份的质量为___________(假设漂白粉中的其它成份不与硝酸反应)。
(2)将14 g Na2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12 L,所得溶液的体积为400 mL。试计算:原混合物中Na2O的质量为___________g,所得溶液中Na+的物质的量为___________。
【答案】Ca(ClO)2+H2O+CO2===CaCO3+2HClO 2HClO![]() 2HCl+O2↑ 2.86 g 6.2 0.4 mol
2HCl+O2↑ 2.86 g 6.2 0.4 mol
【解析】
(1)①漂白粉长期露置在空气中会与空气中的水和二氧化碳反应生成次氯酸,且次氯酸不稳定,故答案为: Ca(ClO)2+H2O+CO2=CaCO3+2HClO、2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
②漂白粉完全变质后其中的有效成分Ca(ClO)2会转化为CaCO3,加入硝酸会发生反应:CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O;二氧化碳的量为448×10-3L÷22.4L/mol=0.02mol; 根据方程式关系,消耗碳酸钙物质的量为0.02mol,Ca(ClO)2物质的量为0.02mol,质量为0.02mol×143g/mol=2.86g;
(2)Na2O和Na2O2的混合物加入足量的水中发生反应:2Na2O2+2H2O=4NaOH+O2↑、Na2O+H2O=2NaOH,生成的氧气的物质的量为:1.12L÷22.4L/mol=0.05mol,则n(Na2O2)=0.05mol×2=0.1mol,m(Na2O2)=0.1 mol×78 g·mol-1=7.8 g,m(Na2O)=14 g-7.8 g=6.2 g;所得溶液中n(Na+)=2 n(Na2O2)+2n(Na2O)= 2×(0.1 mol+0.1 mol)=0.4 mol,故答案为:6.2、0.4 mol。


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】指出下列说法正确的是( )
A.生物体内进行的缓慢氧化反应是放热反应。
B.化学键形成时释放的能量越多,化学键越活泼。
C.需要加热条件的化学反应都是吸热反应
D.1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列溶液一段时间后再加入一定量的某种物质(方括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
A. AgNO3 [AgNO3] B. NaOH [H2O]
C. KCl [KCl] D. CuSO4 [Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的不可能是( )
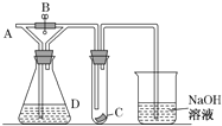
A. 浓H2SO4 B. NaOH溶液 C. 澄清石灰水 D. 饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 在化学反应过程中,发生物质变化的同时不一定发生能量变化
B. 煤、石油、天然气均为化石能源,是非再生能源
C. 生成物的总焓大于反应物的总焓时,反应吸热,ΔH<0
D. ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性![]() 下列说法正确的是
下列说法正确的是![]()
A. 简单离子半径: ![]()
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性: ![]()
D. 最高价氧化物的水化物的酸性: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠块加入硫酸铜溶液中,出现的现象是( )
A. 有金属铜析出 B. 产生气体,有金属铜析出 C. 生成蓝色沉淀 D. 产生气体,生成蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。宝鸡因钛产业发达被称为中国钛谷,其钛产品产量占全国80%以上,占世界产量的20%以上。请回答下列问题:
(1)钛元素位于周期表中第4周期_____族,基态铁原子的价电子的电子排布式为______。
(2)钛元素在化合物中有+2、+3、+4等多种价态,试分析因显著的“压电效应“面被广泛应用于超声波发生装置中的偏钛酸钡(BaTiO3)中Ti的化合价为______。
(3)TiCl3是一种不稳定的氯化物,主要用作强还原制、烯烃聚合的催化剂以及偶氮染料分析等。
①溶波中的Ti3+易被FeCl3氧化,发生反应的离子方程式为________;若利用此反应原理,用已知标准浓度FeCl3溶液来滴定某含Ti3+的溶液时,可选用______溶液作指示剂判断滴定的终点。
②化学式为[Ti(H2O)6]Cl3的绿色晶体是TCl3的六水合物的一种晶型,该晶体中,与Ti3+T形成配位键的原子是_____(填元素符号),该原子的杂化类型为________;该晶体所含元素中,电负性最大的元素是_______(写出元素符号)。
③化学式为[Ti(H2O)5Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1mol绿色晶体溶于水配成500mL溶液,加入足量AgNO3使Cl-完全沉淀,消耗AgNO3的物质的量为____mol。
④写出一种与H2O互为等电子体的阳离子______(填化学式)。
(4)TiO2的熔点为1800℃,TiCl4的熔点为-25℃,同为Ti的+4价化合物,熔点相差悬殊的原因是___________。
(5)自然界的钛主要以金红石( 主要成分为TiO2)的形式存在。TiO2 的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2 的摩尔质量为M g/mol,阿伏加德罗常数的值为NA,根据图中所示数据列出该晶体密度的计算式ρ=_______g·cm-3(用NA表示阿伏伽德罗常数,用含M、a、b、c的代数式表示)。
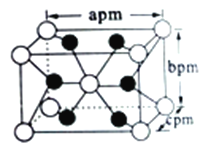
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com