
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性![]() 下列说法正确的是
下列说法正确的是![]()
A. 简单离子半径: ![]()
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性: ![]()
D. 最高价氧化物的水化物的酸性: ![]()
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某化工厂用氯气与石灰乳生产漂白粉,该厂出厂产品说明书如下:

①漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式:_____________________________;______________。
②某实验室研究员将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,收集到标准状况下448 mL气体,则该漂白粉中所含有效成份的质量为___________(假设漂白粉中的其它成份不与硝酸反应)。
(2)将14 g Na2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12 L,所得溶液的体积为400 mL。试计算:原混合物中Na2O的质量为___________g,所得溶液中Na+的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E五种物质都含有同一种元素,它们之间的转化关系如图所示,其中A为淡黄色固体化合物,B为单质。请回答下列问题。

(1)固体A的名称为_______________,其常见用途:_______________________________________。(仅举一例即可)
(2)写出下列反应的化学方程式:
①A→C_____________________________________________________________;
②A→D_____________________________________________________________;
③B→A_____________________________________________________________;
④B→C_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某品牌饮用矿物质水标签的部分内容。下列说法正确的是

A. 标签上给出的离子的物理量是物质的量浓度
B. 任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L之间
C. 该品牌饮用矿物质水中c(Mg2+)的最大值为2×10-4 mol/L
D. 一瓶该品牌饮用矿物质水中SO42-的物质的量不超过1×10-5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常用烧碱来清洗抽油烟机上的油渍(主要成分是油脂),下列说法不正确的是( )
A. 烧碱具有强腐蚀性,故清洗时必须戴防护手套
B. 热的烧碱溶液去油渍效果更好
C. 清洗时,油脂在碱性条件下发生水解反应
D. 油脂属于天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上硫化碱法制备Na2S2O2的原理是2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应的△H<0),某研究小组在实验室用此法制备Na2S2O2的装置与步骤如下,请回答有关问题:
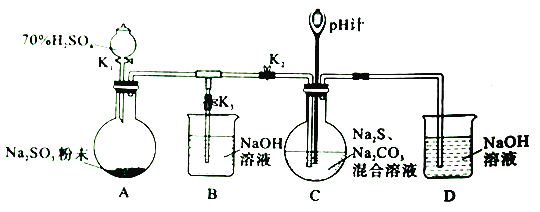
I、制备Na2S2O2实验步骤如下:
步骤1:先组装仪器,然后________。
步骤2:添加药品。关闭K1、K2、K3按图中所示依固体、溶液顺序将所需药品加入各仪器。
步骤3:打开K2,关闭K3,调节K1,使硫酸缓慢匀速滴下,导管口有气泡冒出,pH计读数逐渐减小。当pH计读数接近7时,打开K3,关闭K1、K2。
步骤4:将C中所得溶液加热浓缩,冷却析出Na2S2O2,经过滤、洗涤、干燥,得到产品。
(1)步骤1中缺少的操作是___________。
(2)装置A中发生反应的化学方程式为___________。
(3)为了使SO2尽可能被吸收完全,在不改变装置C中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可以采取的措施有________(任写一条)。
(4)装置C中Na2S和Na2CO3的物质的量浓度之比约为2:1,若Na2S过量则C中会出现淡黄色的浑浊,用离子方程式解释其原因为____________。
(5)实验制得的Na2S2O3产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验,检测Na2S2O3产品中是否存在Na2SO4杂质,简要说明实验操作、现象和结论_____________。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用浓度为0.1000mol/L碘的标准溶液滴定。反应原理为2S2O32-+I2=S4O62-+2I-
(6)滴定至终点时的现象为____________。
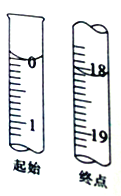
(7)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL,计算所得样品的纯度为_________(用含W的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com